��Ŀ����
����Ŀ������һ����Ҫ�Ļ���ԭ�ϣ�ijѧϰС������ȡ������̽�������ʣ���ش�
��1��ʵ������ȡ�����Ļ�ѧ����ʽ�� ��
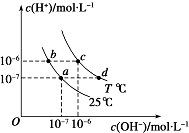
��2����С��ͬѧ�������ͼ��ʾ��ʵ��װ�ã����ּг�����δ��������̽�������Ļ�ԭ�Բ������� 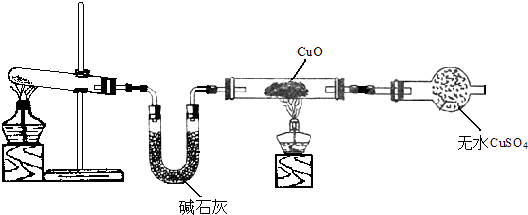
��ʵ������Ϊ����ɫCuO��Ϊ��ɫ����ɫˮCuSO4��ĩ��Ϊ��ɫ��ͬʱ����һ����ɫ���壬����������Ⱦ����д��������CuO��Ӧ�Ļ�ѧ����ʽ ��
�ڼ�ʯ�ҵ������� ��
��3����ͬѧ��Ϊ��NH3��CuO��Ӧ�ĺ�ɫ�����п��ܺ���Cu2O����֪��Cu2O��һ�ּ����������������Һ�У�Cu+���ȶ��Ա�Cu2+�Cu2O+2H+=Cu+Cu2++2H2O����̽��ʵ����ȡС����ɫ�������Թ��У����� �� ����Һ�г��� �� ��˵������Cu2O��
���𰸡�
��1��2NH4Cl+Ca��OH��2![]() CaCl2+2NH3��+2H2O
CaCl2+2NH3��+2H2O
��2��3CuO+2NH3![]() 3Cu+N2+3H2O�����հ����л��е�ˮ����,��ֹ���Ų���ˮ�IJⶨ
3Cu+N2+3H2O�����հ����л��е�ˮ����,��ֹ���Ų���ˮ�IJⶨ
��3��ϡH2SO4����ɫ
���������⣺��1���Ȼ�������������ڼ������������ɰ������Ȼ��ơ�ˮ������ʽΪ��2NH4Cl+Ca��OH��2 ![]() CaCl2+2NH3��+2H2O��
CaCl2+2NH3��+2H2O��
���Դ��ǣ�2NH4Cl+Ca��OH��2 ![]() CaCl2+2NH3��+2H2O�� ��2���ٰ�����CuO��Ӧ����ͭ��������ˮ����ѧ����ʽ��3CuO+2NH3
CaCl2+2NH3��+2H2O�� ��2���ٰ�����CuO��Ӧ����ͭ��������ˮ����ѧ����ʽ��3CuO+2NH3 ![]() 3Cu+N2+3H2O��
3Cu+N2+3H2O��
���Դ��ǣ�3CuO+2NH3 ![]() 3Cu+N2+3H2O��
3Cu+N2+3H2O��
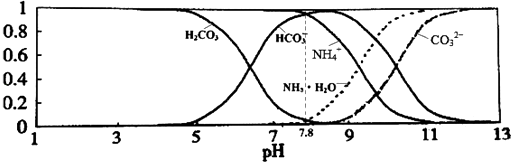
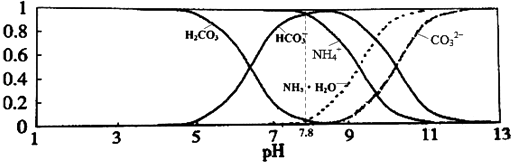
�ڼ�ʯ���ǰ�ɫ����ɫ��ĩ�����ɶ�ף���Ҫ�������ƺ��������ƵĻ�����Ҫ��Ϊ����������������������������������ͬʱҲ�������������������壬�������̼���������÷�Ӧ��ȡ�İ�������ˮ��������ֹ���Ų���ˮ�IJⶨ����ʯ����������ã�
���Դ��ǣ����հ����л��е�ˮ��������ֹ���Ų���ˮ�IJⶨ����3��ͭ��������Һ�г���ɫ��������ͭ�ܺ��ᷴӦ����ͭ���ӣ���Һ����ɫ��Ϊ��ɫ��ͭ���������Ե����Ӧ�����ݸ������ܷ���ᷴӦ�жϣ�̽��ʵ�鲽��Ϊ��ȡ������Ʒ���Թ��У�����ϡH2SO4������Һ������ɫ��˵����ɫ�����к���Cu2O����֮��û�У�
���Դ��ǣ�ϡH2SO4����ɫ��
�����㾫����ͨ��������ð��Ļ�ѧ���ʺͰ���ʵ�����Ʒ���������ˮ��Ӧ��NH3��Ωһ��ʹ��ʪ�ĺ�ɫʯ����ֽ���������壬���ô����ʼ���NH3�����ᷴӦ��NH3+HCl=NH4Cl�����ɰ��̣�����O2��Ӧ��4NH3+5O2=4NO+6H2O+Q��

 ѧҵ����һ��һ��ϵ�д�
ѧҵ����һ��һ��ϵ�д�����Ŀ�����ᶡ����CH3COOCH2CH2CH2CH3���Ǿ��й���ζ���㾫����������Ӧ�ɽ������ᶡ���ĺϳɣ��й����ʵ��������ʼ������ϳɹ������£���һ���������������������ϼ��ȷ���������Ӧ���ڶ�����ϴ���ᴿ���������������ᴿ��
���� | 1������ | ���ᶡ�� | |
�۵�/�� | 16.6 | ��89.5 | ��73.5 |
�е�/�� | 117.9 | 117 | 126.3 |
�ܶ�/gcm��3 | 1.05 | 0.81 | 0.88 |
ˮ���� | ���� | ���� | ���� |

��1�������Ǻϳɺ��ᴿ���ᶡ�����й�װ��ͼ����д���ϳɺ��ᴿ���ᶡ���IJ���˳������ĸ��
C��F�������� ��
��2��Cװ���г���װ��1�����������������⣬����Ҫ������ �� װ��C�������ܵ������ǣ���
��3������F��������Ӧ��ɺ���ж�µ���ƿ�м���25mLˮ�������� �� Aװ����Na2CO3��Һ�������� ��
��4��װ��A�ķ�Һ©����Һ���Ϊ���㣬���ᶡ��Ӧ�������ϡ��£��㣮
��5����һ��������Ӧ�����п��ܵõ����л�����������д���������ʵĽṹ��ʽ����