题目内容
【题目】某化工厂按如下步骤进行生产:①以煤为燃料煅烧碳酸钙;②用饱和Na2CO3溶液吸收步骤①中产生的CO2(转化为小苏打NaHCO3);③使步骤①中产生的CaO跟水反应生成消石灰;④消石灰跟Na2CO3溶液反应,所得产品之一循环利用.下列说法不正确的是( )
A.生产过程中没有涉及到氧化还原反应
B.生产过程中没有涉及到置换反应
C.该厂生产的主要原料为煤、纯碱
D.该厂生产的最终产品是小苏打及烧碱
【答案】AC
【解析】解:以煤为燃料煅烧石灰石,反应的方程式为:CaCO3 ![]() CaO+CO2↑,反应物为石灰石,生成物为氧化钙和二氧化碳,该反应属分解反应;用饱和碳酸钠溶液充分吸收①中产生的二氧化碳(Na2CO3+CO2+H2O═2NaHCO3),①中的二氧化碳又作为反应物参加反应,同时生成碳酸氢钠,该反应属化合反应;
CaO+CO2↑,反应物为石灰石,生成物为氧化钙和二氧化碳,该反应属分解反应;用饱和碳酸钠溶液充分吸收①中产生的二氧化碳(Na2CO3+CO2+H2O═2NaHCO3),①中的二氧化碳又作为反应物参加反应,同时生成碳酸氢钠,该反应属化合反应;
①中产生的氧化钙跟水反应,同样a中的氧化钙又作为反应物参加反应,生成氢氧化钙;消石灰与碳酸钠溶液反应,反应的方程式为:Ca(OH)2+Na2CO3=CaCO3↓+2NaOH,该反应属复分解反应,
A、煤为燃料煅烧石灰石,生产过程中涉及到氧化还原反应,故A错误;
B、生产过程中没有涉及到置换反应,故B正确;
C、该厂生产的主要原料为煤、纯碱、石灰石,故C错误;
D、该厂生产的最终产品是小苏打及烧碱,故D正确;
故选AC.

 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案【题目】已知苯甲酸微溶于水,易溶于乙醇、乙醚,有弱酸性,酸性比醋酸强.它可用于制备苯甲酸乙酯和苯甲酸铜. (一)制备苯甲酸乙酯![]() +C2H5OH
+C2H5OH ![]()
![]() +H2O
+H2O
相关物质的部分物理性质如上表格:
催化剂组分质量分数(%) | CuO | 0 | 25 | 50 | 75 | 100 |
ZnO | 100 | 75 | 50 | 25 | 0 | |
达到平衡所需要时间(h) | 2.5 | 7.4 | 8.1 | 12 | 无催化剂 | |
实验流程如下:
(1)制备苯甲酸乙酯,下列装置最合适的是 , 反应液中的环己烷在本实验中的作用 . 
(2)步骤②控制温度在65~70℃缓慢加热液体回流,分水器中逐渐出现上、下两层液体,直到反应完成,停止加热.放出分水器中的下层液体后,继续加热,蒸出多余的乙醇和环己烷.反应完成的标志是 .
(3)步骤③碳酸钠的作用是 , 碳酸钠固体需搅拌下分批加入的原因 .
(4)步骤④将中和后的液体转入分液漏斗分出有机层,水层用25mL乙醚萃取,然后合并至有机层,用无水MgSO4干燥.乙醚的作用 .
(5)步骤⑤蒸馏操作中,下列装置最好的是(填标号),蒸馏时先低温蒸出乙醚,蒸馏乙醚时最好采用(水浴加热、直接加热、油浴加热). 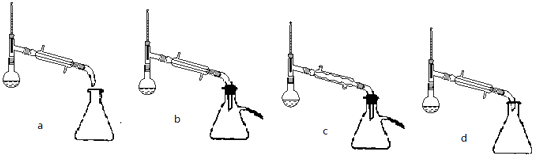
(6)(二)制备苯甲酸铜 将苯甲酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2粉未,然后水浴加热,于70~80℃下保温2~3小时;趁热过滤,滤液蒸发冷却,析出苯甲酸铜晶体,过滤、洗涤、干燥得到成品.
混合溶剂中乙醇的作用是 , 趁热过滤的原因
(7)本实验中下列药品不能代替氢氧化铜使用的是
A.醋酸铜
B.氧化铜
C.碱式碳酸铜
D.硫酸铜
(8)洗涤苯甲酸铜晶体时,下列洗涤剂最合适的是
A.冷水
B.热水
C.乙醇
D.乙醇水混合溶液.