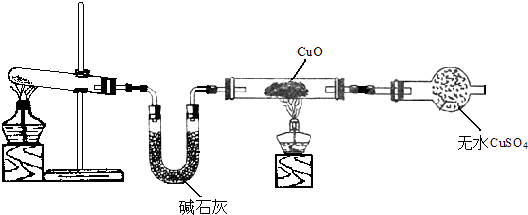
题目内容
【题目】常温下,现有0.1mol/L的NH4HCO3溶液,pH=7.8.已知含氮(或含碳)各微粒的分布分数(平衡时某种微粒的浓度占各种微粒浓度之和的分数)与pH的关系如图所示.下列说法正确的是( ) 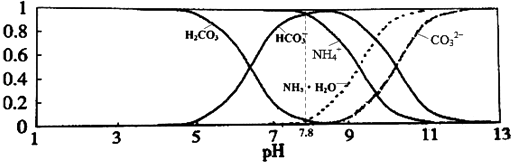
A.当溶液的pH=9时,溶液中存在下列关系:c(NH4+)>c(HCO3﹣)>c(NH3H2O)>c(CO32﹣)
B.NH4HCO3溶液中存在下列守恒关系:c(NH4+)+c(NH3H2O)+c(H+)=c(OH﹣)+2c(CO32﹣)+c(H2CO3)
C.往该溶液中逐滴滴加氢氧化钠时NH4+和HCO3﹣浓度逐渐减小
D.通过分析可知常温下Kb(NH3H2O)>Ka1(H2CO3)
【答案】D
【解析】解:A.结合图象可知,溶液的pH=9时,溶液中离子浓度大小为:c(HCO3﹣)>c(NH4+)>c(NH3H2O)>c(CO32﹣),故A错误; B.NH4HCO3溶液中存在物料守恒:c(NH4+)+c(NH3H2O)=c(HCO3﹣)+c(CO32﹣)+c(H2CO3),由于碳酸氢根离子的水解程度较小,则c(NH4+)+c(NH3H2O)+c(H+)>c(OH﹣)+2c(CO32﹣)+c(H2CO3),故B错误;
C.0.1mol/L的NH4HCO3溶液的pH=7.8,根据图象可知,当溶液pH增大时,铵根离子浓度逐渐减小,而碳酸氢根离子能够先增大后减小,故C错误;
D.由于0.1mol/L的NH4HCO3溶液的pH=7.8,说明碳酸氢根离子的水解程度大于铵根离子的水解程度,则一水合氨的电离平衡常数大于Ka1(H2CO3),故D正确;
故选D.
A.当pH=9时,结合图象判断溶液中各离子浓度大小;
B.根据碳酸氢铵溶液中的物料守恒分析;
C.该碳酸氢铵溶液的pH=7.8,结合图象判断滴入氢氧化钠溶液后NH4+和HCO3﹣浓度变化;
D.碳酸氢铵溶液显示碱性,根据盐的水解原理判断二者的酸碱性强弱及电离平衡常数大小.

【题目】已知苯甲酸微溶于水,易溶于乙醇、乙醚,有弱酸性,酸性比醋酸强.它可用于制备苯甲酸乙酯和苯甲酸铜. (一)制备苯甲酸乙酯![]() +C2H5OH
+C2H5OH ![]()
![]() +H2O
+H2O
相关物质的部分物理性质如上表格:
催化剂组分质量分数(%) | CuO | 0 | 25 | 50 | 75 | 100 |
ZnO | 100 | 75 | 50 | 25 | 0 | |
达到平衡所需要时间(h) | 2.5 | 7.4 | 8.1 | 12 | 无催化剂 | |
实验流程如下:
(1)制备苯甲酸乙酯,下列装置最合适的是 , 反应液中的环己烷在本实验中的作用 . 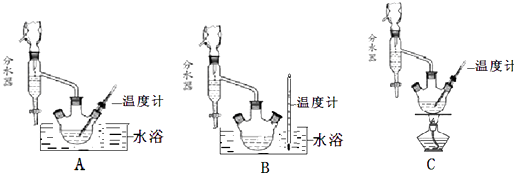
(2)步骤②控制温度在65~70℃缓慢加热液体回流,分水器中逐渐出现上、下两层液体,直到反应完成,停止加热.放出分水器中的下层液体后,继续加热,蒸出多余的乙醇和环己烷.反应完成的标志是 .
(3)步骤③碳酸钠的作用是 , 碳酸钠固体需搅拌下分批加入的原因 .
(4)步骤④将中和后的液体转入分液漏斗分出有机层,水层用25mL乙醚萃取,然后合并至有机层,用无水MgSO4干燥.乙醚的作用 .
(5)步骤⑤蒸馏操作中,下列装置最好的是(填标号),蒸馏时先低温蒸出乙醚,蒸馏乙醚时最好采用(水浴加热、直接加热、油浴加热). 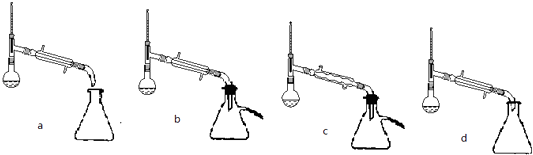
(6)(二)制备苯甲酸铜 将苯甲酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2粉未,然后水浴加热,于70~80℃下保温2~3小时;趁热过滤,滤液蒸发冷却,析出苯甲酸铜晶体,过滤、洗涤、干燥得到成品.
混合溶剂中乙醇的作用是 , 趁热过滤的原因
(7)本实验中下列药品不能代替氢氧化铜使用的是
A.醋酸铜
B.氧化铜
C.碱式碳酸铜
D.硫酸铜
(8)洗涤苯甲酸铜晶体时,下列洗涤剂最合适的是
A.冷水
B.热水
C.乙醇
D.乙醇水混合溶液.