题目内容
13.下列排列顺序正确的是( )| A. | 原子半径:O>N>C | B. | 热稳定性:H2O>HF>H2S | ||
| C. | 碱性:KOH>NaOH>Mg(OH)2 | D. | 酸性:H3PO4>H2SO4>HClO4 |
分析 A.同一周期元素,原子半径随着原子序数增大而减小;
B.元素的非金属性越强,其氢化物的稳定性越强;
C.元素的金属性越强,其最高价氧化物的水化物碱性越强;
D.元素的非金属性越强,其最高价氧化物的水化物酸性越强.
解答 解:A.同一周期元素,原子半径随着原子序数增大而减小,所以原子半径C>N>O,故A错误;
B.元素的非金属性越强,其氢化物的稳定性越强,非金属性F>O>S,所以热稳定性:HF>H2O>H2S,故B错误;
C.元素的金属性越强,其最高价氧化物的水化物碱性越强,金属性K>Na>Mg,所以碱性:KOH>NaOH>Mg(OH)2,故C正确;
D.元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性Cl>S>P,所以酸性:H3PO4<H2SO4<HClO4,故D错误;
故选C.
点评 本题考查元素周期律,侧重考查学生分析推断能力,明确金属性、非金属性强弱判断方法是解本题关键,知道非金属性强弱与氢化物的稳定性、最高价氧化物的水化物酸性强弱关系,题目难度不大.

练习册系列答案
相关题目
18.下列金属的冶炼,均不能用热还原法制得一组是( )
| A. | Na、Ca、Mg、Al、K | B. | Na、K、Zn、Fe、Hg | C. | Zn、Fe、Cu、Ag、Sn | D. | Mg、Al、Zn、Fe、Pb |
4.向NaOH和Na2CO3的混合溶液(其物质的量浓度相等)中加入盐酸后,下列离子方程式与事实不相符的是( )
| A. | CO32-+OH-+2H+═HCO3-↑+H2O | B. | CO32-+2OH-+3H+═HCO3-+2H2O | ||
| C. | CO32-+2OH-+4H+═CO2↑+3H2O | D. | CO32-+OH-+3H+═CO2↑+2H2O |
1.化学用语是学习化学的重要工具,可用来表示物质的组成.物质的结构和物质的变化等,下列用于表示物质结构的化学用语表述正确的是( )
| A. | 乙烯的结构简式:CH2CH2 | B. | H2O2的结构式:H-0-0-H | ||
| C. | 氮气的电子式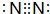 | D. | CH4分子的比例模型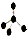 |
8.下列说法中,不正确的是( )
| A. | ${\;}_{1}^{1}$H和${\;}_{1}^{2}$H互为同位素 | B. | 淀粉和纤维素互为同分异构体 | ||
| C. |  和 和 属于同一种物质 属于同一种物质 | D. | CH4和C2H6互为同系物 |
5.下列除杂方法中正确的一组是( )
| A. | 溴苯中混有溴,加入氢氧化钠溶液,振荡、静置、分液 | |
| B. | 苯中混有苯酚,加浓溴水后过滤 | |
| C. | 乙烷中混有乙烯,通过盛有酸性KMnO4溶液的洗气瓶洗气 | |
| D. | 乙酸乙酯中混有乙酸,可选用饱和Na2CO3溶液,振荡、静置、分液 |
2.某有机物A用质谱仪测定如图①,核磁共振氢谱示意图如图①,核磁共振氢谱示意图如图②,则A的结构简式可能为( )
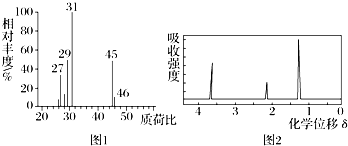

| A. | CH3CH2OH | B. | CH3CHO | C. | HCOOH | D. | CH3CH2CH2COOH |
3.下列实验操作与结论相符的是( )
| A. | 将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中 | |
| B. | 某气体能使湿润的红色石蕊试纸变蓝,该气体水溶液一定显碱性 | |
| C. | 某无色溶液中加Ba(NO3)2溶液,再加稀盐酸,沉淀不溶解,则原溶液中一定有SO42- | |
| D. | 在蔗糖与稀硫酸共热后的溶液中加入新制Cu(OH)2,加热煮沸,会生成砖红色沉淀 |
 在已经发现的一百多种元素中,除稀有气体外,非金属元素只有十多种,但与生产生活有密切的联系.
在已经发现的一百多种元素中,除稀有气体外,非金属元素只有十多种,但与生产生活有密切的联系.