题目内容
2.铬是不锈钢中一种重要的元素,铬的毒性与其存在的价态有关,低价铬对人体基本无害,六价铬比三价铬毒性高100倍,并易被人体吸收且在体内蓄积,有关含铬化合物的相互转化关系如图甲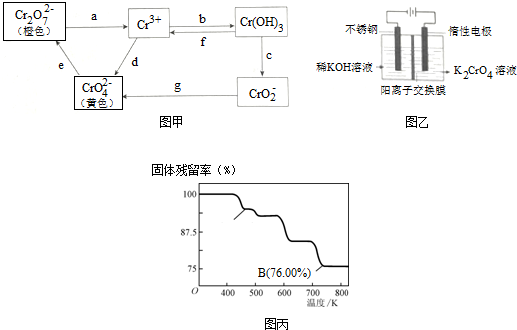
回答下列问题:
(1)从图中信息判断,Cr(OH)3是两性氢氧化物(填写“酸性”、“碱性”或“两性”),相关反应的离子方程式为Cr(OH)3+3H+=Cr3++3H2O、Cr(OH)3+OH-=CrO2-+2H2O.
(2)图中所示转化过程中需要加入氧化剂的是dg(填写表示转化过程的小写字母).
(3)在水溶液中橙色的Cr2O72-与黄色的CrO42-有下列平衡关系:Cr2O72-+H2O?2CrO42-+2H+.
①向K2Cr2O7稀溶液中加入NaOH溶液后,溶液颜色的变化是由橙色变为黄色.
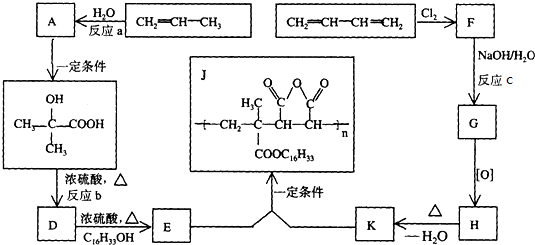
②以铬酸钾(K2CrO4)为原料,电化学法制备重铬酸钾(K2Cr2O7)的实验装置示意图如图乙:
阳极室中的电极反应式是4OH--4e-═2H2O+O2↑,阴极室中的KOH的物质的量变大(填写“变大”、“变小”或“不变”).
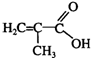
(4)CrO3具有强氧化性,热稳定性较差,加热时逐步分解,其固体残留率($\frac{剩余固体的质量}{原始固体的质量}$×100%)随温度的变化如图丙所示.
①三氧化铬在稀硫酸环境中氧化乙醇,CrO3变为绿色的Cr2(SO4)3,乙醇被完全氧化为CO2,则其化学方程式是4CrO3+C2H5OH+6H2SO4=2Cr2(SO4)3+2CO2↑+9H2O.
②图中B点所示固体的化学式是Cr2O3.
分析 (1)由图转化关系可知Cr(OH)3可与酸反应生成Cr3+,与碱反应生成CrO2-;
(2)根据化合价的变化判断,需加入氧化剂,则Cr元素化合价升高;
(3)①向K2Cr2O7稀溶液中加入NaOH溶液,平衡正向移动;
②以铬酸钾(K2CrO4)为原料,电化学法制备重铬酸钾(K2Cr2O7),由Cr2O72-+H2O?2CrO42-+2H+可知,阳极生成氧气和H+,Cr2O72-+H2O?2CrO42-+2H+平衡逆向移动生成K2Cr2O7,阴极生成OH-;
(4)①酸性条件下,CrO3和C2H5OH发生氧化还原反应生成Cr2(SO4)3和CO2,结合质量守恒书写;
②根据质量守恒定律,在变化过程中,Cr的质量没有变,计算B中Cr、O原子质量,进而计算计算氧原子和铬原子的个数比确定化学式.
解答 解:(1)由图转化关系可知Cr(OH)3可与酸反应生成Cr3+,离子方程式为Cr(OH)3+3H+=Cr3++3H2O,与碱反应生成CrO2-,离子方程式为Cr(OH)3+OH-=CrO2-+2H2O,故答案为:两性;Cr(OH)3+3H+=Cr3++3H2O、Cr(OH)3+OH-=CrO2-+2H2O;
(2)Cr3+转化为CrO42-,CrO2-转化为CrO42-,Cr元素化合价升高,需加入氧化剂,故答案为:dg;
(3)①向K2Cr2O7稀溶液中加入NaOH溶液,平衡正向移动,颜色由橙色变为黄色,故答案为:由橙色变为黄色;
②以铬酸钾(K2CrO4)为原料,电化学法制备重铬酸钾(K2Cr2O7),由Cr2O72-+H2O?2CrO42-+2H+可知,阳极生成氧气和H+,电极方程式为4OH--4e-═2H2O+O2↑,
Cr2O72-+H2O?2CrO42-+2H+平衡逆向移动生成K2Cr2O7,阴极生成OH-,KOH的物质的量变大,
故答案为:4OH--4e-═2H2O+O2↑;变大;
(4)①酸性条件下,CrO3和C2H5OH发生氧化还原反应生成Cr2(SO4)3和CO2,方程式为4CrO3+C2H5OH+6H2SO4=2Cr2(SO4)3+2CO2↑+9H2O,
故答案为:4CrO3+C2H5OH+6H2SO4=2Cr2(SO4)3+2CO2↑+9H2O;
②设CrO3的质量为100g,则CrO3中铬元素的质量为100g×$\frac{52}{52+16×3}$=52g,B点时固体的质量为:100g×76%=76g,Cr的质量没有变,所以生成物中Cr元素的质量为52g,氧元素的质量为76g-52g=24g,Cr、O原子个数比为$\frac{52}{52}$:$\frac{24}{16}$=2:3,所以B点时剩余固体的成分是Cr2O3,故答案为:Cr2O3.
点评 本题考查较综合,涉及无机物推断、氧化还原反应、电解池原理等知识点,同时考查学生获取信息、加工信息能力,需要学生具备扎实的基础,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 用水可以鉴别乙醇、苯、和溴苯 | |
| B. | 甲苯与氯气在光照下可发生取代反应,主要生成2,4-二氯甲苯 | |
| C. | 化学式为C7H16的有机物,分子中含有3个甲基的可能结构有3种 | |
| D. | 乙酸丁酯中含乙酸杂质,可以加入饱和碳酸钠溶液洗涤,然后通过分液来去除杂质 |
| A. | 20% | B. | 33.3% | C. | 50% | D. | 75% |
| A. | 某芳香烃的分子式为C10H14,它不能使溴水褪色,但可使酸性KMnO4溶液褪色,且分子结构中只有一个烷基,符合条件的烃有3种 | |
| B. | 某有机化合物完全燃烧生成等物质的量的CO2和H2O,则该有机物的分子式一定CnH2n | |
| C. | 甲烷、甲醛、甲酸都不存在同分异构体,则甲醚(CH3OCH3)也无同分异构体 | |
| D. | HOCH2COOH既可发生取代反应,也可发生加聚反应 |
| A. | X的非金属性强于W,所以X的氢化物沸点高于W的氢化物沸点 | |
| B. | Y、Z均为金属元素,故X、Y、Z三种元素不能形成化合物 | |
| C. | 工业上常利用电解ZW3溶液冶炼金属Z | |
| D. | Y、W的最高价氧化物水化物均能溶解Z单质 |
 +C16H33OH$→_{△}^{浓硫酸}$
+C16H33OH$→_{△}^{浓硫酸}$ +H2OE+K→J
+H2OE+K→J