题目内容
16.关于下列各图的叙述中正确的是( )| A. |  表示A、B两物质的溶解度随温度变化情况,将tl℃时A、B的饱和溶液分别升温至t2℃时(水不减少),溶质的质量分数B>A | |
| B. |  表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH小于同浓度的NaB溶液的pH | |
| C. |  表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8 kJ•mol-1 | |
| D. | 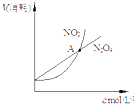 表示恒温恒容条件下,2NO2(g)═N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 |
分析 A、物质溶解度随温度升高增大,升温溶质溶剂不变,知识饱和溶液变为不饱和溶液;
B、酸性越弱对应盐的水解显碱性,水解程度越大,溶液pH越大;
C、燃烧热是1mol可燃物完全反应生成稳定氧化物放出的热量;
D、依据图象中起点和变化趋势,结合化学平衡分析判断.
解答 解:A、B两物质的溶解度随温度变化情况,将t1℃时,AB溶解度相同,A、B的饱和溶液质量分数相同,分别升温至t2℃时,溶解度增大,但溶液浓度不变溶质的质量分数B=A,故A错误;
B、图中两种酸PH相同,稀释HA、HB两种酸的稀溶液时,HA的PH增大的多,HBPH增大的少,说明HA酸的酸性强于HB的酸性,所以同浓度的NaA溶液水解程度小于NaB溶液,NaA溶液PH小于NaB溶液,故B正确;
C、图象中2mol氢气完全燃烧生成的是水蒸气时放热241.8kJ,不是氢气的燃烧热,故C错误;
D、图中二氧化氮和四氧化二氮气态都是从0开始,横坐标向右表示浓度增大 纵坐标向上表示物质消耗速率快,A点表示反应速率相等,不能确定平衡状态,如果达到平衡状态,则二者消耗速率之比等于化学计量数之比即应该等于2:1,此时才能够达到平衡状态,故D错误;
故选B.
点评 本题考查了各种图象的分析思路和变化特征的应用,主要是燃烧热的概念应用,平衡状态的判断,饱和溶液中溶质溶解度和质量分数的判断,弱酸稀释的PH变化判断酸的强弱.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.有A、B、C、D四种金属,将A与B用导线连接起来,浸入稀硫酸溶液中,B为正极,将A、D分别投入等浓度盐酸中,D比A反应剧烈,将铜浸入B的盐溶液里,无明显变化,如果把铜浸入C的盐溶液里,有金属C析出,据此判断它们的活动性由强到弱的顺序是( )
| A. | DABC | B. | DCAB | C. | BADC | D. | ABCD |
7.下列说法不正确的是( )
| A. | CO2,CH4,O2等均是温室效应的气体 | |
| B. | 使用清洁能源是防止酸雨发生的重要措施之一 | |
| C. | 磁共振谱可以鉴别1-溴丙烷和2-溴丙烷 | |
| D. | 合理开发利用可燃冰(固态甲烷水合物)有助于缓解能源紧缺 |
11.下列除杂(括号内的物质为杂质)操作正确的是( )
| A. | 乙酸(乙酸钠、水):加入硫酸,后结晶、过滤 | |
| B. | 乙酸乙酯(乙酸):加入饱和碳酸钠溶液,后分液 | |
| C. | 苯(苯酚):加入浓溴水,后过滤 | |
| D. | 氢氧化铁胶体(FeCl3):渗析 |
1.某恒温密闭容器中,可逆反应A(s)?B+C(g)△H=-a KJ/mol 达到平衡.缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等.以下分析正确的是( )
| A. | 产物B的状态只能为固态或液态 | |
| B. | 保持体积不变,向平衡体系中加入B,平衡可能向逆反应方向移动 | |
| C. | 若开始时向容器中加入1molB和1molC,达到平衡时放出热量a KJ | |
| D. | 衡时,单位时间内n(A)消耗﹕n(C)消耗=1﹕1 |
5.下列离子方程式,书写正确的是( )
| A. | 盐酸与碳酸钡反应 CO32-+2H+═CO2↑+H2O | |
| B. | 硫酸铜溶液中滴加氢氧化钡溶液 Ba2++2OH-+Cu2++SO42-═BaSO4↓+Cu(OH)2↓ | |
| C. | 硝酸银溶液中加入铜粉 Ag++Cu═Cu2++Ag↓ | |
| D. | 铁与稀盐酸反应 2Fe+6H+═2Fe3++3H2↑ |
6.下列变化需加氧化剂才能实现的是( )
| A. | NH3→NH4+ | B. | N2→NH3 | C. | NH3→NO | D. | Cl2→Cl- |