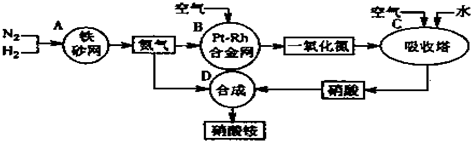
题目内容
11.下列除杂(括号内的物质为杂质)操作正确的是( )| A. | 乙酸(乙酸钠、水):加入硫酸,后结晶、过滤 | |
| B. | 乙酸乙酯(乙酸):加入饱和碳酸钠溶液,后分液 | |
| C. | 苯(苯酚):加入浓溴水,后过滤 | |
| D. | 氢氧化铁胶体(FeCl3):渗析 |
分析 A.都溶于水,不能用过滤的方法除杂;
B.乙酸乙酯不溶于饱和碳酸钠溶液,乙酸与碳酸钠反应;
C.溴、三溴苯酚都溶于苯;
D.胶体不能透过半透膜.
解答 解:A.乙酸钠与硫酸反应生成乙酸和硫酸钠,都溶于水,不能用过滤的方法除杂,应蒸馏,故A错误;
B.乙酸乙酯不溶于饱和碳酸钠溶液,乙酸与碳酸钠反应,可用分液的方法分离,故B正确;
C.苯酚与溴反应生成三溴苯酚,溴、三溴苯酚都溶于苯,应用氢氧化钠溶液除杂,故C错误;
D.胶体不能透过半透膜,可用渗析的方法分离,故D正确.
故选BD.
点评 本题考查物质的分离和提纯,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质的异同,除杂时不能引入新的杂质.

练习册系列答案
 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案
相关题目
4.在盛有稀H2SO4的烧杯中放入导线连接的锌片和铜片,下列叙述正确的是( )
| A. | 正极附近的SO42-浓度逐渐增大 | B. | 电子通过导线由铜片流向锌片 | ||
| C. | 正极有O2逸出 | D. | 铜片上有H2逸出 |
19.CoC12•6H20是一种饲料营养强化剂.一种利用水钴矿[主要成分为Co203、Co(OH)3,还含少量Fe203、A1203、MnO等]制取CoC12•6H20的工艺流程如图1:
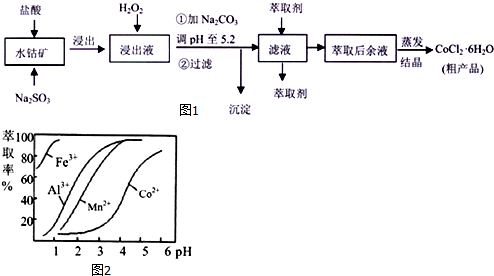
己知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等; ②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(1)浸出过程中加Na2S03的作用是将Fe3+、Co3+还原.
(2)写出浸出液中加氧化剂H202发生反应的离子方程式2Fe2++H2O2+2H+=2Fe3++2H2O.
(3)加Na2C03调pH至5.2的目的是完全沉淀Fe3+、Al3+.
(4)萃取剂对金属离子的萃取率与pH的关系如图2.萃取剂的作用是除去溶液中的Mn2+;其使用的较适宜pH范围是B.
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5
(5)为测定粗产品中CoC12•6H20的含量,称取一定质量的粗产品溶于水,加入足量AgN03溶液,过滤、洗涤,将沉淀烘干后称其质量.若沉淀未烘干就直接称量,则会导致粗产品中CoCl2•6H20的质量分数的计算结果大于实际值(填大于、等于或小于).

己知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等; ②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(2)写出浸出液中加氧化剂H202发生反应的离子方程式2Fe2++H2O2+2H+=2Fe3++2H2O.
(3)加Na2C03调pH至5.2的目的是完全沉淀Fe3+、Al3+.
(4)萃取剂对金属离子的萃取率与pH的关系如图2.萃取剂的作用是除去溶液中的Mn2+;其使用的较适宜pH范围是B.
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5
(5)为测定粗产品中CoC12•6H20的含量,称取一定质量的粗产品溶于水,加入足量AgN03溶液,过滤、洗涤,将沉淀烘干后称其质量.若沉淀未烘干就直接称量,则会导致粗产品中CoCl2•6H20的质量分数的计算结果大于实际值(填大于、等于或小于).
6.锂被誉为“金属味精”以LiCoO2为正极材料的锂离子电池已被广泛用作便携式电源.工业上常以β-锂辉矿(主要成分为LiAlSi2O6,还含有FeO、MgO、CaO等杂质)为原料来制取金属锂.其中一种工艺流程如下:
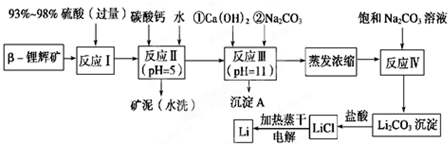
已知:①部分金属氢氧化物开始沉淀和完全沉淀时的pH:
②Li2CO3在不同温度下的溶解度如下表:
请回答下列问题:
(1)用氧化物形式表示LiAlSi2O6的组成:Li2O•Al2O3•4SiO2.
(2)反应Ⅱ加入碳酸钙的作用是除去反应Ⅰ中过量的H2SO4,控制pH,使Fe3+、Al3+完全沉淀.
(3)写出沉淀A的成分Mg(OH)2、CaCO3.
(4)反应Ⅳ生成Li2CO3沉淀,写出在实验室中得到Li2CO3沉淀的操作名称过滤,洗涤所得Li2CO3沉淀要使用热水 (选填“热水”或“冷水”),你选择的理由是Li2CO3在较高温度下溶解度小,用热水洗涤可减少Li2CO3的损耗.
(5)电解熔融氯化锂生产锂时,阳极产生的氯气中会混有少量氧气,原因是加热蒸干LiCl溶液时,LiCl有少量水解生成LiOH,受热分解生成Li2O,电解时产生O2.

已知:①部分金属氢氧化物开始沉淀和完全沉淀时的pH:
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.7 | 9.6 |
| 完全沉淀pH | 3.7 | 4.7 | 11 |
| 温度/℃ | 0 | 10 | 20 | 50 | 75 | 100 |
| Li2CO3的溶解度/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
(1)用氧化物形式表示LiAlSi2O6的组成:Li2O•Al2O3•4SiO2.
(2)反应Ⅱ加入碳酸钙的作用是除去反应Ⅰ中过量的H2SO4,控制pH,使Fe3+、Al3+完全沉淀.
(3)写出沉淀A的成分Mg(OH)2、CaCO3.
(4)反应Ⅳ生成Li2CO3沉淀,写出在实验室中得到Li2CO3沉淀的操作名称过滤,洗涤所得Li2CO3沉淀要使用热水 (选填“热水”或“冷水”),你选择的理由是Li2CO3在较高温度下溶解度小,用热水洗涤可减少Li2CO3的损耗.
(5)电解熔融氯化锂生产锂时,阳极产生的氯气中会混有少量氧气,原因是加热蒸干LiCl溶液时,LiCl有少量水解生成LiOH,受热分解生成Li2O,电解时产生O2.
16.关于下列各图的叙述中正确的是( )
| A. |  表示A、B两物质的溶解度随温度变化情况,将tl℃时A、B的饱和溶液分别升温至t2℃时(水不减少),溶质的质量分数B>A | |
| B. |  表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH小于同浓度的NaB溶液的pH | |
| C. |  表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8 kJ•mol-1 | |
| D. | 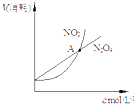 表示恒温恒容条件下,2NO2(g)═N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 |
3.关于如图所示装置的叙述,错误的是( )


| A. | 锌是负极,其质量逐渐减小 | B. | 氢离子在铜表面被还原,产生气泡 | ||
| C. | 电子从锌片经导线流向铜片 | D. | 电子从锌片经硫酸溶液流向铜片 |
20.化合物X是一种重要的有机合成中间体,用于制造塑料、涂料和粘合剂等高聚物.为研究X的组成与结构,某研究小组进行了如下实验:
(4)化合物X与乙烯的共聚物是一种热熔型粘合剂.合成这种粘合剂的化学方程式是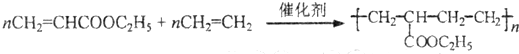 .
.
(5)研究小组以乙烯为原料,在实验室合成了化合物X.请写出合成路线流程图,并注明反应条件.
已知: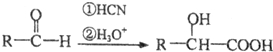
合成路线流程图示例如下:$→_{条件1}^{试剂1}$产物$→_{条件2}^{试剂2}$产物2…,下列合成步骤可以用完,也可以不用完,不够时也可以自己加.前面合成出来的物质可以作为原料在后面的合成中直接使用(如图).
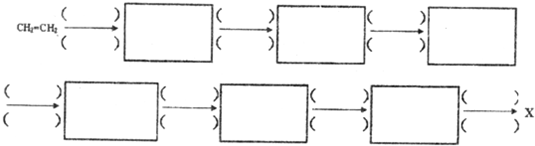
(6)工业上合成化合物X的一种方法可用如图表示:

已知: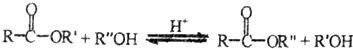
①1mol链状化合物A能与2mol H2发生反应,但A分子中不含有碳碳三键,则A的结构简式是CH2=C=O.
②B分子中含有四元环状结构,则反应I的反应类型是加成反应;反应Ⅱ的化学方程式是 .
.
③与(5)实验室制法比较,本方法的优点是步骤少,原子利用率高.
(1)化合物X的质谱图为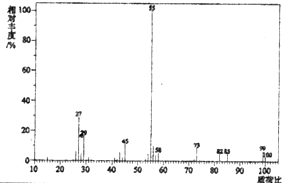 | (1)有机物X的相对分子质量是100. |
| (2)将10.0g X在足量O2中充分燃烧,并使其产物依次通过足量的无水CaCl2和KOH浓溶液,发现无水CaCl2增重7.2g,KOH浓溶液增重22.0g. | (2)有机物X的分子式是C5H8O2. |
| (3)经红外光谱测定,化合物X中含有酯基,并有和羰基直接相连的碳碳双键;化合物 X的核磁共振氢谱图上有4个吸收峰,峰面积之比是2:1:2:3. | (3)X的结构简式是 . . |
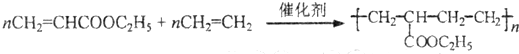 .
.(5)研究小组以乙烯为原料,在实验室合成了化合物X.请写出合成路线流程图,并注明反应条件.
已知:
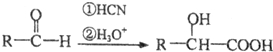
合成路线流程图示例如下:$→_{条件1}^{试剂1}$产物$→_{条件2}^{试剂2}$产物2…,下列合成步骤可以用完,也可以不用完,不够时也可以自己加.前面合成出来的物质可以作为原料在后面的合成中直接使用(如图).

(6)工业上合成化合物X的一种方法可用如图表示:

已知:
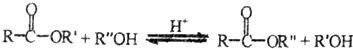
①1mol链状化合物A能与2mol H2发生反应,但A分子中不含有碳碳三键,则A的结构简式是CH2=C=O.
②B分子中含有四元环状结构,则反应I的反应类型是加成反应;反应Ⅱ的化学方程式是
 .
.③与(5)实验室制法比较,本方法的优点是步骤少,原子利用率高.