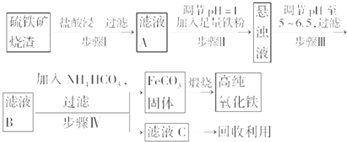
题目内容
6.下列变化需加氧化剂才能实现的是( )| A. | NH3→NH4+ | B. | N2→NH3 | C. | NH3→NO | D. | Cl2→Cl- |
分析 需加氧化剂才能实现,则选项中为还原剂的发生的氧化反应,还原剂中某元素的化合价升高,以此来解答.
解答 解:A.元素化合价不变,不是氧化还原反应,故A错误;
B.N元素化合价降低,应加入还原剂,故B错误;
C.N元素化合价升高,加入氧化剂可实现,故C正确;
D.Cl元素化合价降低,应加入还原剂,故D错误.
故选C.
点评 本题考查氧化还原反应,为高考常见题型,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应还原剂的考查,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
16.关于下列各图的叙述中正确的是( )
| A. |  表示A、B两物质的溶解度随温度变化情况,将tl℃时A、B的饱和溶液分别升温至t2℃时(水不减少),溶质的质量分数B>A | |
| B. |  表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH小于同浓度的NaB溶液的pH | |
| C. |  表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8 kJ•mol-1 | |
| D. | 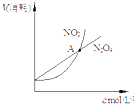 表示恒温恒容条件下,2NO2(g)═N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 |
17.下列所涉及的反应不属于置换反应的是( )
| A. | 用铝热反应焊接铁轨 | |
| B. | 镁条在二氧化碳中燃烧 | |
| C. | 用铝和氢氧化钠溶液反应制取氢气 | |
| D. | 用铜和氯化铁溶液反应,制作印刷电路板 |
14.下列物质不属于电解质的是( )
| A. | 金刚石 | B. | NaCl | C. | NaOH | D. | BaSO4 |
11.能够证明苯分子不存在碳碳单、双键交替排布的事实是( )
| A. | 苯的一溴代物没有同分异构体 | B. | 苯的间位二溴代物只有一种 | ||
| C. | 苯能在空气中燃烧 | D. | 苯的邻位二溴代物只有一种 |
18. 500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应.反应过程中H2、N2和NH3的物质的量变化如图所示,下列说法中正确的是( )
500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应.反应过程中H2、N2和NH3的物质的量变化如图所示,下列说法中正确的是( )
 500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应.反应过程中H2、N2和NH3的物质的量变化如图所示,下列说法中正确的是( )
500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应.反应过程中H2、N2和NH3的物质的量变化如图所示,下列说法中正确的是( )| A. | 从反应开始到第一次平衡时,N2的平均反应速率为0.005 mol•L-1•min-1 | |
| B. | 平衡在10 min至20 min的变化,可能是因为增大了容器体积 | |
| C. | 25 min时,分离出了0.1 mol NH3 | |
| D. | 在25 min后平衡向正反应方向移动,新平衡中NH3的体积分数比原平衡的小 |