题目内容
11.下列说法正确的是( )| A. | △H<0、△S>0的反应在温度低时不能自发进行 | |
| B. | 在其他外界条件不变的情况下,使用催化剂可改变化学反应进行的方向 | |
| C. | 因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据 | |
| D. | NH4HCO3(s)═NH3 (g)+H2O(g)+CO2 (g)△H=+185.57 kJ/mol可能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 |
分析 A、依据反应自发进行的判断依据是△H-T△S<0分析判断;
B、催化剂改变反应速率,不能改变化学平衡;
C、反应自发进行需要由焓变和熵变温度共同决定;
D、反应是熵增大的反应,自发进行的反应,判断依据△H-T△S<0分析判断.
解答 解:A、△H<0、△S>0的反应,△H-T△S<0在任何温度都能自发进行,故A错误;
B、在其他外界条件不变的情况下,使用催化剂,可以改变化学反应速率,但不能改变化学平衡和反应方向,故B错误;
C、反应自发进行需要由焓变和熵变温度共同决定,故C错误;
D、反应△H>0、△S>0,能自发进行说明,△H-T△S<0,原因是体系有自发地向混乱度增加的方向转变的倾向,故D正确;
故选D.
点评 本题考查了反应自发进行的判断依据,化学平衡影响因素的分析判断,题目较简单.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.决定化学反应速率快慢的主要因素是( )
| A. | 温度 | B. | 浓度 | C. | 催化剂 | D. | 反应物的性质 |
2.在如图串联装置中,通电片刻即发现乙装置左侧电极表面出现红色固体,则下列说法错误的是( )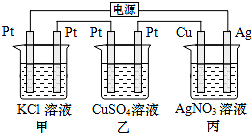

| A. | 标准状况下当甲中产生4.48 L气体时,丙中Cu电极质量增加21.6g | |
| B. | 电解过程中丙中溶液pH无变化 | |
| C. | 向甲中加入适量的盐酸,可使溶液恢复到电解前的状态 | |
| D. | 乙中左侧电极反应式:Cu2++2e-═Cu |
19.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,22.4L CCl4中含有的分子数为NA | |
| B. | 常温下,23g Na完全被氧化失去的电子数为NA | |
| C. | 标准状况下,22.4L CH4中含有的电子数为NA | |
| D. | 0.3mol•L-1AlCl3溶液中含有的氯离子数为0.9NA |
3.氯水中存在如下平衡:Cl2(g)?Cl2(aq)、Cl2(aq)+H2O?H++Cl-+HClO.下列说法正确的是( )
| A. | 向饱和氯水中通入HCl,有c(H+)═c(Cl-)+c(OH-)+c(ClO-) | |
| B. | 氯气在1mol•L-1的NaCl溶液中比在1mol•L-1的AlCl3溶液中的溶解度小 | |
| C. | 光照,氯水的漂白性增强 | |
| D. | 若向饱和氯水中通入少量H2S,则$\frac{c({H}^{+})}{c(ClO^-)}$减小 |
12.下列叙述正确的是( )
| A. | 在碱金属元素中,所有碱金属的氧化物均属于碱性氧化物 | |
| B. | 由于钠、钾的密度都小于1,所以,碱金属单质的密度都小于1 | |
| C. | 金属锂不能保存于煤油中,金属钾可以保存于煤油中 | |
| D. | 碱金属元素单质的熔点按Li、Na、K、Rb、Cs顺序递增,密度也递增 |
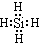 ;比较热稳定性:乙<NH3(填>,<或=).
;比较热稳定性:乙<NH3(填>,<或=).