题目内容
7.NaHCO3和 KHCO3的混合物6.2g与100mL 盐酸恰好完全反应,得到标准状况下CO2的体积为1.568L.求:
(1)混合物中NaHCO3的质量是多少?
(2)盐酸的物质的量的浓度是多少?
分析 NaHCO3和KHCO3与盐酸都发生反应:HCO3-+H+=CO2↑+H2O,令混合物中NaHCO3和KHCO3的物质的量分别为xmol、ymol,根据二者质量之和与二氧化碳的体积列方程计算x、y的值,
(1)根据m=nM计算混合物中NaHCO3的质量;
(2)由方程式可知n(HCl)=n(CO2),再根据c=$\frac{n}{V}$计算盐酸的物质的量浓度.
解答 解:(1)解:NaHCO3和KHCO3与盐酸都发生反应:HCO3-+H+=CO2↑+H2O
NaHCO3~HCl~CO2
1 1 1
n(NaHCO3)n(HCl) n(CO2)
KHCO3~HCl~CO2
1 1 1
n(KHCO3)n(HCl) n(CO2)
84g/mol×n(NaHCO3)+100 g/mol×n(KHCO3)=6.2g
n(NaHCO3)+n(KHCO3)=$\frac{1.568L}{22.4L/mol}$
解得:n(NaHCO3)=0.05 mol,n(KHCO3)=0.02mol
m(NaHCO3)=84g/mol×0.05 mol=4.2g;
答:混合物中NaHCO3的质量是4.2g;
(2)c(HCl)=$\frac{0.07mol}{0.1L}$=0.7mol/L.
答:盐酸的物质的量的浓度是0.7mol/L.
点评 本题考查混合物的计算、根据方程式的计算等,题目难度不大,注意利用离子方程式的利用.

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目
17.某有机物的结构简式为HCOOCH2CH=CHCl,它不具有的官能团是( )
| A. | 酯基 | B. | 碳碳双键 | C. | 羧基 | D. | 卤原子 |
18.(NH4)2S04在一定条件下发生如下反应:4(NH4)2S04=N2+6NH3+3S02+S03+7H20,将反应后的混合气体通入Ba(N03)2溶液,产生的沉淀为( )
| A. | BaS04和BaS03 | B. | BaS04 | C. | BaS03 | D. | BaS |
2.下列离子方程式书写正确的是( )
| A. | 等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合:Ba2++2OH-+NH4++HCO3-=BaCO3↓+NH3•H2O+H2O | |
| B. | 氯化铝溶液中加入过量的氨水:Al3++4 NH3•H2O=4NH4++AlO2-+2H2O | |
| C. | 向次氯酸钙溶液中通入少量的二氧化硫:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO | |
| D. | 碳酸钠溶液中加入过量的苯酚: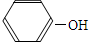 +CO32-= +CO32-= +HCO3- +HCO3- |
12.下列各组物质在溶液中起反应时,离子方程式相同的是( )
| A. | 氯化钡与硫酸钠,氢氧化钡与硫酸 | |
| B. | 碘化钾与氯气,溴化钾与氯气 | |
| C. | 碳酸银与盐酸,硝酸银与盐酸 | |
| D. | 碳酸氢钠与稀硫酸,碳酸氢钾与盐酸 |
19.t℃时,CuSO4在水中的溶解度为25g,将32gCuSO4白色粉末加入mg水中形成饱和CuSO4溶液并有CuSO4•5H2O晶体析出,则m的取值范围是( )
| A. | 18g≤m≤128g | B. | 36g<m<180g | C. | 18g<m<128g | D. | 36g≤m≤180g |
16.关于分类的知识说法错误的是( )
| A. | 分类法是学习和研究化学物质及化学变化的一种科学方法 | |
| B. | 常见的分类方法有交叉分类法和树形分类法 | |
| C. | 对于相同的分类对象,采用的分类标准不同,分类的结果也不同 | |
| D. | 初中的化学知识告诉我们,化学反应可以分为化合反应和分解反应两大类 |
17.常温常压下,等物质的量的下列物质所占有的最大体积的是( )
| A. | MgO | B. | FeCl2 | C. | CO | D. | H2O |
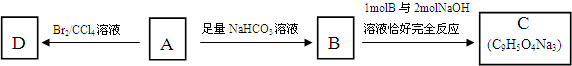
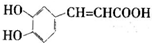 .
.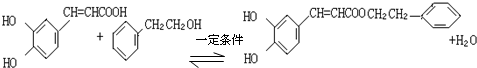 .
.