题目内容
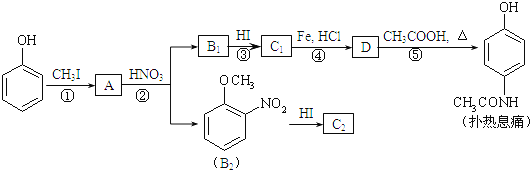
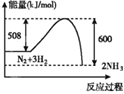
【题目】海洋中有丰富的矿产、能源和水产资源,如图所示利用海水的部分流程。
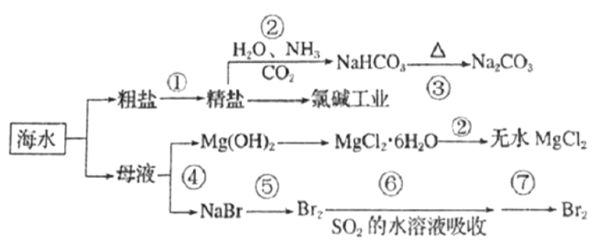
下列有关说法正确的是( )
A. 步骤②制取NaHCO3的原理是利用其溶解度比较小
B. 步骤②属于化合反应,步骤③属于分解反应
C. 在⑤⑥⑦步骤中,溴元素均被氧化
D. 工业上通过电解饱和MgCl2溶液制取金属镁
【答案】A
【解析】
A.相同条件下碳酸氢钠的溶解度小于碳酸钠的溶解度,则制取NaHCO3的反应是利用其溶解度比较小,A项正确;
B.步骤②的反应为NaCl+CO2+H2O+NH3=NaHCO3↓+NH4Cl,有2种产物,不是化合反应,B项错误;
C.在步骤⑥中,Br2和SO2反生反应SO2+Br2+2H2O=2HBr+H2SO4;其中Br的化合价降低得到Br-,被还原,C项错误;,
D.Mg是活泼金属,电解其溶液得不到Mg单质,而是电解熔融的MgCl2,D项错误;本题答案选A。

 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案【题目】下表是元素周期表的一部分,X、Y、Z、W为短周期主族元素,W的原子序数是Z的2倍。下列说法中正确的是
X | Y | Z | ||
W |
A.简单离子半径:Y<Z
B.Y元素的最高价氧化物对应的水化物在一定条件下可以和X单质反应
C.氢化物的沸点:X<Z
D.WZ2具有漂白性,其漂白原理与双氧水相同
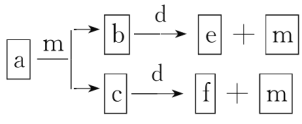
【题目】下表为元素周期表的一部分,a、b、c…为部分元素。回答下列问题:
a | |||||||||||||||||
b | c | d | e | ||||||||||||||
f | g | ||||||||||||||||
h | |||||||||||||||||
(1)请画出上述元素h的原子结构示意图_______;元素h位于元素周期表的第_____区。
(2)e、g两种元素的气态氢化物中更稳定的是_______(写化学式);
(3)b2a2分子的电子式是________ ,该分子中存在的σ键与π键的个数比为_______。
(4)c、d两种元素中第一电离能较大的是_________(写元素符号)。
(5)f和g两种元素形成的化合物是______(填“离子化合物”“共价化合物”)。a2d分子是_________分子(填极性分子或者非极性分子)。