题目内容
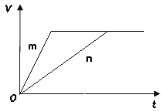
【题目】已知溶液中,还原性HSO3>I-,氧化性IO3->I2。在含有3molNaHSO3的溶液中逐滴加入KIO3溶液,加入KIO3和析出I2的物质的量的关系如图所示,则下列说法中错误的是
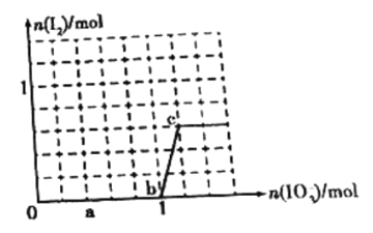
A. a点时NaHSO3剩余
B. b点时还原产物为I-
C. b点到c点,KIO3与NaHSO3反应生成I2
D. 加入的KIO3为0.4mol或1.12mol时,反应后溶液中I-均为0.4mol
【答案】C
【解析】
试题依题意,该反应是按如下顺序进行的:
3HSO3-+IO3-=3SO42-+I-+3H+;(此处只能生成I-,因为还原性HSO3->I-)
IO3-+5I-+6H+=3I2+3H2O
A、此处只能是NaHSO3过量,正确;B、b点时还原产物还应该是碘离子,b点后就变为碘单质了,正确;C、b点到c点,KIO3与碘离子反应生成单质碘,错误;D、,正确。

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案
相关题目