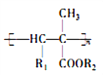
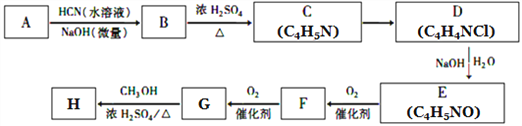
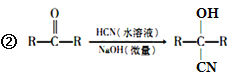
题目内容
【题目】工业上采用软锰矿(主要成分为MnO2)来制取硫酸锰,工艺流程如下:

已知:浸出液中的金属离子主要是Mn2+,还含有少量的Fe2+。回答下列问题:
(1)实验室进行过滤操作时用到的玻璃仪器有玻璃棒、_____________________。
(2)操作Ⅰ的目的是_______________________和调节溶液的PH至3~4。检验过滤后的滤液中是否含有Fe3+的操作是___________________________________________________________________。
(3)通过煅烧MnSO4·H2O可制得软磁铁氧体材料(MnxO4),在不同温度下煅烧MnSO4·H2O时剩余质量变化的曲线如图所示。根据图中数据可得MnxO4中x的值为______________。A到B过程中分解得到的气体中SO2与SO3的物质的量之比为2∶1,写出该过程中发生反应的化学方程式:______________

【答案】 漏斗、烧杯 用MnO2将Fe2+氧化成Fe3+ 取少量滤液,滴加KSCN溶液,若不显红色,则过滤后的溶液中不含Fe3+ 3 6MnSO4 =2Mn3O4+4SO2↑+ 2SO3↑+O2 ↑
【解析】(1)实验室进行过滤操作时用到的玻璃仪器除了玻璃棒之外,还有盛液体的烧杯、制作过滤器的漏斗。
(2)浸出液中的金属离子主要是Mn2+,还含有少量的Fe2+,所以操作Ⅰ的目的是除去浸出液中的Fe2+,用MnO2将Fe2+氧化成Fe3+,然后调节pH至3~4,促进Fe3+水解生成Fe(OH)3而除去;铁离子与KSCN溶液发生显色反应,所以检验过滤后的滤液中是否含有Fe3+的操作是:取少量滤液,滴加KSCN溶液,若不显红色,则过滤后的溶液中不含Fe3+。
(3)由曲线可知MnSO4·H2O为25.35mg,MnxO4为11.45mg,则根据锰元素守恒可知![]() =
=![]() x,解得x=3;A曲线时固体减少的质量为25.35mg-22.65mg=2.7mg,因为原固体中结晶水的质量为25.35mg×
x,解得x=3;A曲线时固体减少的质量为25.35mg-22.65mg=2.7mg,因为原固体中结晶水的质量为25.35mg×![]() =2.7mg,所以A曲线对应的物质为MnSO4,又因为A到B过程中分解得到的气体中SO2与SO3的物质的量之比为2∶1,所以A到B过程中发生反应的化学方程式为:6MnSO4=2Mn3O4+4SO2↑+2SO3↑+O2↑。
=2.7mg,所以A曲线对应的物质为MnSO4,又因为A到B过程中分解得到的气体中SO2与SO3的物质的量之比为2∶1,所以A到B过程中发生反应的化学方程式为:6MnSO4=2Mn3O4+4SO2↑+2SO3↑+O2↑。