题目内容
14.乙醇分子中有各种化学键.如: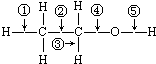 关于乙醇在下列各种反应中,对化学键断裂的说法正确的是( )
关于乙醇在下列各种反应中,对化学键断裂的说法正确的是( )| A. | 乙醇跟钠反应时,化学键④断裂 | |
| B. | 乙醇在Cu作催化剂条件下生成乙醛的反应中,化学键①⑤断裂 | |
| C. | 乙醇跟浓H2SO4共热到170℃时,化学键①④断裂 | |
| D. | 乙醇跟醋酸、浓H2SO4共热时,化学键④断裂 |
分析 A.根据乙醇与与金属钠反应生成乙醇钠和氢气,断开的羟基上的氢氧键;
B.根据乙醇在铜作用下反应生成乙醛和水,断开的是羟基上的氢氧键和与羟基所连的碳的氢;
C.乙醇和浓H2SO4共热至170℃时,碳氧键、与羟基所连的碳的相邻的碳上的碳氢键断裂;
D.乙醇与酸发生酯化反应,断开的羟基上的氢氧键.
解答 解:A.乙醇与钠反应取代羟基上氢原子,反应时键⑤断裂,故A错误;
B.乙醇在铜作用下反应生成乙醛,乙醇中的键③⑤断裂,故B错误;
C.乙醇和浓H2SO4共热至170℃时,碳氧键、与羟基所连的碳的相邻的碳上的碳氢键断裂,反应时键①④断裂,故C正确;
D.和乙酸、浓硫酸共热发生酯化反应时,键⑤断裂,故D错误.
故选C.
点评 本题主要考查了乙醇的化学性质,掌握反应的机理是解题的关键,难度不大.

练习册系列答案
相关题目
5.观察下列模型并结合有关信息,判断有关说法不正确的是( )
| B12结构单元 | SF6分子 | S8分子 | HCN | |
| 结 构 模 型 示 意 图 | 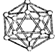 | 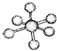 | 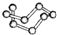 |  |
| 备注 | 熔点1873K | 易溶于CS2 |
| A. | 单质硼属于原子晶体,结构单元中含有30个B-B键,含有20个正三角形 | |
| B. | SF6是由极性键构成的非极性分子 | |
| C. | 固态硫S8属于原子晶体 | |
| D. | HCN的结构式为H-C≡N |
2.下列叙述中错误的是( )
| A. | 点燃前甲烷不必验纯 | |
| B. | 甲烷燃烧能放出大量的热,所以是一种很好的气体燃料 | |
| C. | 煤矿的矿井要注意通风和严禁烟火,以防爆炸事故的发生 | |
| D. | 甲烷是一种具有正四面体结构的很稳定的气体 |
19.CaC2和ZnC2、Al4C3、Mg2C3、Li2C2等都同属离子化合物,通过对CaC2制C2H2的反应进行思考,从中得到启示,判断下列碳化物水解后的有机产物相同的是( )
| A. | Zn2C | B. | Al4C3 | C. | Mg2C3 | D. | Li2C2 |
6.关于配制物质的量浓度溶液的说法中正确的是( )
| A. | 配制一定物质的量浓度溶液的实验中,不需要精确量取水的用量 | |
| B. | 溶液注入容量瓶前不需要恢复到室温 | |
| C. | 用胶头滴管定容后需反复倒转摇匀,若发现液面低于刻度线时要小心地加些水 | |
| D. | 若加水定容时超过了刻度线,赶快用胶头滴管吸走超出的部分 |
3.部分弱酸的电离平衡常数如表:
下列选项正确的是( )
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡 常数(25℃) | Ki=1.77×10-4 | Ki=4.9×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
| A. | 2CN-+H2O+CO2═2HCN+CO32- | |
| B. | 2HCOOH+CO32-═2HCOO-+H2O+CO2↑ | |
| C. | 等浓度的HCOONa和NaCN溶液的pH前者大于后者 | |
| D. | 中和等浓度的HCOOH和HCN消耗NaOH的量前者等于后者 |
4.有机物分子中原子间(或原子与原子团间)的相互影响会导致物质化学性质的不同.下列事实不能说明上述观点的是( )
| A. | 甲苯能使酸性高锰酸钾溶液褪色,苯不能使酸性高锰酸钾溶液褪色 | |
| B. | 苯酚能跟NaOH溶液反应,乙醇不能与NaOH溶液反应 | |
| C. | 乙烯能发生加成反应,乙烷不能发生加成反应 | |
| D. | 苯与硝酸在加热时发生取代反应,甲苯与硝酸在常温下就能发生取代反应 |
 、取代反应
、取代反应 、加聚反应
、加聚反应
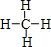 ,它与H的单质在光照下的第一步反应为CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl该反应属于取代反应.
,它与H的单质在光照下的第一步反应为CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl该反应属于取代反应.