题目内容
9.请按要求回答问题:
(1)写出下列元素符号是:E:F Q:Ca.
(2)元素周期表中最高正价氧化物对应水化物酸性最强的酸是:HClO4(填化学式).
(3)写出表示含有8个质子、10个中子的原子的化学符号:188O.
(4)元素周期表中位于第8纵行的铁元素属于Ⅷ族.
(5)F、G、D三种元素氢化物的稳定性由大到小的顺序为:H2O>H2S>SiH4.(填化学式)
(6)A、D、H三种元素以1:1:1比例组成的化合物的化学式为:HClO.
(7)B的最简单氢化物的结构式为
 ,它与H的单质在光照下的第一步反应为CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl该反应属于取代反应.
,它与H的单质在光照下的第一步反应为CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl该反应属于取代反应.(8)单质B可以与G元素的最高价氧化物对应的水合物反应,请写出相应的化学方程式:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$=2SO2↑+CO2↑+2H2O.
分析 (1)由元素在周期表中位置,可知A为氢、B为碳、C为氮、D为氧、E为氟、F为Si、G为硫、H为Cl、Q为Ca;
(2)元素周期表中最高正价氧化物对应水化物酸性最强的酸是高氯酸;
(3)原子符号AZX,X为元素符号,左下角Z为质子数,左上角A为质量数,其中质量数=质子数+中子数;
(4)Fe元素位于Ⅷ族;
(5)非金属性越强,氢化物越稳定;
(6)A、D、H三种元素以1:1:1比例组成的化合物HClO;
(7)B的最简单氢化物为CH4,与氯气在光照条件下发生取代反应;
(8)G元素的最高价氧化物对应的水合物为硫酸,碳与浓硫酸反应生成二氧化碳、二氧化硫与水.
解答 解:(1)由元素在周期表中位置,可知A为氢、B为碳、C为氮、D为氧、E为氟、F为Si、G为硫、H为Cl、Q为Ca,故答案为:F;Ca;
(2)元素周期表中最高正价氧化物对应水化物酸性最强的酸是高氯酸,其化学式为HClO4,故答案为:HClO4;
(3)含有8个质子、10个中子的原子,为O原子,其质量数为8+10=18,该原子符号为:188O,故答案为:188O;
(4)Fe元素属于Ⅷ族元素,故答案为:Ⅷ;
(5)非金属性Si<S<O,非金属性越强,氢化物越稳定,故氢化物稳定性:H2O>H2S>SiH4,故答案为:H2O>H2S>SiH4;
(6)A、D、H三种元素以1:1:1比例组成的化合物HClO,故答案为:HClO;
(7)B的最简单氢化物为CH4,其结构式为: ,与氯气在光照条件下发生取代反应,第一步反应为:CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl,
,与氯气在光照条件下发生取代反应,第一步反应为:CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl,
故答案为: ;CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl;取代;
;CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl;取代;
(8)G元素的最高价氧化物对应的水合物为硫酸,碳与浓硫酸反应生成二氧化碳、二氧化硫与水,反应方程式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$=2SO2↑+CO2↑+2H2O,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$=2SO2↑+CO2↑+2H2O.
点评 本题考查元素周期表与元素周期律综合应用,难度不大,需要学生熟练掌握元素周期表的结构,侧重对基础知识的巩固.

反应历程为①O3═02+O(慢);②O3+O═2O2(快).下列说法正确的是:( )
| A. | 臭氧比氧气稳定 | B. | 臭氧分解的反应速率由步骤①决定 | ||
| C. | 反应的活化能等于285kJ•mol-1 | D. | 氧原子是该反应的催化剂 |
| A. | 常温下都可用锌制容器贮存 | B. | 常温下都能与铜较快反应 | ||
| C. | 露置于空气中,溶液质量均减轻 | D. | 露置于空气中,溶液浓度均降低 |
| A. | NH3的电子式: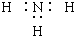 | |
| B. | 氯气的化学式:Cl | |
| C. | 氮气的电子式: | |
| D. | 硫酸铝的电离方程式:Al2(SO4)3═Al3++SO42- |
 关于乙醇在下列各种反应中,对化学键断裂的说法正确的是( )
关于乙醇在下列各种反应中,对化学键断裂的说法正确的是( )| A. | 乙醇跟钠反应时,化学键④断裂 | |
| B. | 乙醇在Cu作催化剂条件下生成乙醛的反应中,化学键①⑤断裂 | |
| C. | 乙醇跟浓H2SO4共热到170℃时,化学键①④断裂 | |
| D. | 乙醇跟醋酸、浓H2SO4共热时,化学键④断裂 |
| A. | 苯分子的模型示意图  | B. | -OH与 都表示羟基 都表示羟基 | ||
| C. | S2-的结构示意图:S2-  | D. | 次氯酸的结构式为:H-Cl-O |
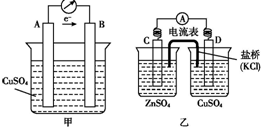
| A. | 若设计成图甲所示的原电池,电极A、B分别是Zn、Cu | |
| B. | 若设计成图乙所示的原电池,D电极反应式为:Cu2++2e-═Cu | |
| C. | 原电池乙工作时,盐桥中的K+移向CuSO4溶液,Cl-移向ZnSO4溶液 | |
| D. | 其他条件相同时,原电池甲比原电池乙的可储存时间长 |
 ,请回答下列问题:
,请回答下列问题: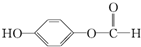 ;
;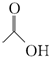 ,在一定条件下,水杨酸与乙酸酐可合成阿司匹林,阿司匹林可表示为:
,在一定条件下,水杨酸与乙酸酐可合成阿司匹林,阿司匹林可表示为: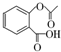 ,则阿司匹林的分子式为C9H8O4.
,则阿司匹林的分子式为C9H8O4.