题目内容
【题目】蕴藏在海底的大量“可燃冰”,其开发利用是当前解决能源危机的重要课题。CH4(g)+2H2O(g)![]() CO2(g)+4H2(g) ΔH3 = +a kJ·mol-1
CO2(g)+4H2(g) ΔH3 = +a kJ·mol-1
化学键 | C—H | H—H | H—O |
键能kJ/mol | b | c | d |
(1)写出甲烷的结构式___________
(2)C=O的键能为_______________kJ/mol (用含a、b、c、d的式子表示)
(3)恒温条件下,在体积恒为0.5L的密闭容器中通入一定量甲烷和水蒸气,发生上述反应。测得甲烷物质的量随时间变化如下表所示。0~10min内用H2O的浓度表示该反应的平均速率为ν(H2O)= _____________
时间/min | 0 | 10 | 20 | 40 | 50 | 60 |
n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 | 0.10 |
(4)恒温恒容情况下,下列叙述能说明此反应达到平衡状态的是_______________。
a.混合气体的平均相对分子质量保持不变 b.CO2和H2的体积分数比为1﹕4
c.混合气体的密度保持不变 d.1mol CO2生成的同时有4mol H-H键断裂
【答案】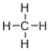 2b+2d-2c-
2b+2d-2c-![]() 0.06 molL1min1 ad
0.06 molL1min1 ad
【解析】
(1)甲烷为正四面体结构,结构式为 ;
;
(2)反应CH4(g)+2H2O(g)![]() CO2(g)+4H2(g)的ΔH3=反应物键能之和-生成物键能之和;设C=O的键能为x,则有4b+4d-(2x+4c)=+a,解得x=(2b+2d-2c-
CO2(g)+4H2(g)的ΔH3=反应物键能之和-生成物键能之和;设C=O的键能为x,则有4b+4d-(2x+4c)=+a,解得x=(2b+2d-2c-![]() )kJ/mol;
)kJ/mol;
(3)0~10min内Δn(CH4)=0.50mol-0.35mol=0.15mol,根据反应方程式可知该时段内Δn(H2O)=0.30mol,容器的容积为0.5L,所以v(H2O)=![]() =0.06 molL1min1;
=0.06 molL1min1;
(4)a.该反应中反应物和生成物均为气体,所以未平衡时气体的总质量不发生改变,该反应前后气体系数之和不相等,所以未平衡时气体的总物质的量改变,则平均相对分子质量会发生改变,当该值不变时说明反应平衡,故a符合题意;
b.反应过程中可能出现CO2和H2的体积分数比为1:4,但这不能说明气体的浓度不再改变,故不能说明反应达到平衡,故b不符合题意;
c.该反应中反应物和生成物均为气体,所以未平衡时气体的总质量不发生改变,容器恒容,则混合气体的密度一直不变,故c不符合题意;
d.CO2生成表示正反应,H-H键断裂表示逆反应,1mol CO2生成的同时有4mol H-H键断裂也即正反应速率与逆反应速率相等,说明反应达到平衡,故d符合题意;
综上所述答案为ad。

 出彩同步大试卷系列答案
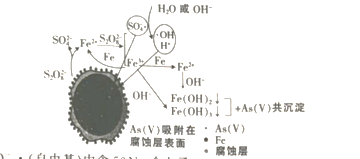
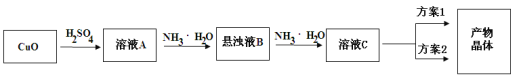
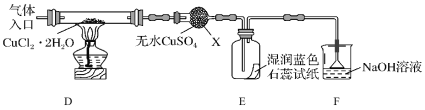
出彩同步大试卷系列答案【题目】硫酸铜晶体(CuSO4·![]() H2O蓝色)在110℃开始失去结晶水,150℃失去全部结晶水,生成白色的无水硫酸铜。依据硫酸铜晶体受热失去结晶水的事实,可以设计硫酸铜晶体水含量
H2O蓝色)在110℃开始失去结晶水,150℃失去全部结晶水,生成白色的无水硫酸铜。依据硫酸铜晶体受热失去结晶水的事实,可以设计硫酸铜晶体水含量![]() 的测定方法。请根据以下实验数据回答相关问题:(M(CuSO4)=159.5g/mol、M(H2O)=18.0g/mol)
的测定方法。请根据以下实验数据回答相关问题:(M(CuSO4)=159.5g/mol、M(H2O)=18.0g/mol)
坩埚质量 | 坩埚和晶体的质量 | 完全失去结晶水后坩埚和剩余固体的质量 |
11.685g | 13.691g | 12.948g |
(1)要完成此实验,至少要称量______次。
(2)![]() ______(保留2位小数),本次实验结果____(填“偏高”、“偏低”)。
______(保留2位小数),本次实验结果____(填“偏高”、“偏低”)。
(3)造成本次误差可能的原因是______。
A. 加热时有晶体溅出
B. 实验前坩埚内有受热不挥发、不分解也不与硫酸铜反应的杂质
C. 粉末未完全变白就停止加热
D. 加热后放在空气中冷却
(4)请写出造成本次误差还有可能存在的其他原因(写出其中一点)_____________________。
(5)如果硫酸铜晶体样品不纯,测定结果________。
A.没有偏差 B. 一定偏小 C. 一定偏大 D. 无法确定
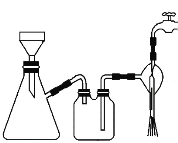
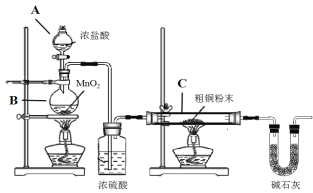
【题目】为探究H2O2、SO2、Br2氧化性强弱,某小组同学设计如下实验(夹持及尾气处理装置已略去,气密性已检验)。

实验操作 | 实验现象 |
ⅰ.打开A中分液漏斗活塞,滴加浓硫酸 | A中有气泡产生,B中红棕色溴水褪色,C中有白色沉淀 |
ⅱ.取C中沉淀加入盐酸 | C中白色沉淀不溶解 |
ⅲ.打开B中分流漏斗活塞,逐滴滴加H2O2 | 开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色 |
(1)A中发生反应的化学方程式是____。
(2)甲同学通过C中产生白色沉淀,得出结论,氧化性:H2O2>SO2。
①乙同学认为不能得出此结论,认为在滴加浓硫酸之前应增加一步操作,该操作是____。
②丙同学认为还应该在B和C之间增加洗气瓶D,D中盛放的试剂是___。
③将乙和丙同学改进后的方案进行实验,C中产生白色沉淀,得出结论:氧化性H2O2>SO2。
(3)ⅲ中滴入少量H2O2没有明显变化。提出假设:
观点1:H2O2的量少不能氧化Br―
观点2:B中有未反应的H2SO3
为验证观点2,应进行的实验操作及现象是________。
(4)通过上述全部实验,得出结论:H2O2、SO2、Br2氧化性由强到弱的顺序是____。