题目内容
【题目】设NA为阿伏加德罗常数的值,下列说法不正确的是
A.标准状况下,22.4 L Cl2与水充分反应,转移电子数为NA
B.31 g P4(分子结构:![]() )中的共价键数目为1.5NA
)中的共价键数目为1.5NA
C.30 g甲醛、乙酸的混合物完全燃烧,产生的CO2分子数目为NA
D.1 L 0.5 mol·L-1的Na2CO3溶液中含有的阴离子总数大于0.5NA
【答案】A
【解析】
A.标准状况下22.4L氯气为1mol,氯气与水反应生成氯化氢和次氯酸,但该反应为可逆反应,1mol氯气不能完全消耗,故转移电子数小于NA,A错误;
B.1mol P4中含有6mol P-P共价键,31g P4物质的量为0.25mol,则0.25mol P4中共有1.5mol共价键,即1.5NA个,B正确;
C.甲醛和乙酸的最简式均为CH2O,30g混合物中有1mol “CH2O”,则1mol混合物完全燃烧生成CO2的分子数为NA,C正确;
D.1 L 0.5 mol·L-1的Na2CO3溶液中,由于碳酸根发生水解反应生成氢氧根,故溶液中阴离子总数大于0.5NA,D正确;
故选A。

【题目】汽车排放的尾气为大气污染物之一,目前,可利用以下化学原理处理汽车尾气:2NO+2CO![]() 2CO2+N2。
2CO2+N2。
(1)写出CO2的结构式____________。
(2)一定条件下,在容积固定的容器中进行上述反应,CO浓度与时间关系如图所示:
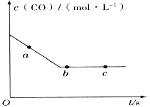
则反应速率v(a)、v(b)、v(c)的大小关系是_______。
(3)为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究。
(资料查阅)A.不同的催化剂对同一反应的催化效率不同;
B.使用等质量相同的催化剂时,催化剂的比表面积对催化效率有影响。
(实验设计)课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验:
实验编号 | 实验目的 | T/℃ | NO初始浓度/(mol/L) | CO初始浓度/(mol/L) | 同种催化剂的比表面积/(m2/g) | c(CO)不变时所用的时间/min |
Ⅰ | 参照实验 | 280 | 6.50×10-5 | 4.00×10-3 | 80 | t |
Ⅱ | 280 | 6.50×10-3 | 4.00×10-3 | 120 | 0.5t | |
Ⅲ | 360 | 6.50×10-3 | 4.00×10-3 | 80 | 0.2t |
(结论)
① 实验编号Ⅱ的实验目的为______________。
② 课题中探究外界条件对汽车尾气转化反应速率的影响的另一因素是_______, 且______反应速率将_______(填“增大”“减小”或“无影响”)。
【题目】蕴藏在海底的大量“可燃冰”,其开发利用是当前解决能源危机的重要课题。CH4(g)+2H2O(g)![]() CO2(g)+4H2(g) ΔH3 = +a kJ·mol-1
CO2(g)+4H2(g) ΔH3 = +a kJ·mol-1
化学键 | C—H | H—H | H—O |
键能kJ/mol | b | c | d |
(1)写出甲烷的结构式___________
(2)C=O的键能为_______________kJ/mol (用含a、b、c、d的式子表示)
(3)恒温条件下,在体积恒为0.5L的密闭容器中通入一定量甲烷和水蒸气,发生上述反应。测得甲烷物质的量随时间变化如下表所示。0~10min内用H2O的浓度表示该反应的平均速率为ν(H2O)= _____________
时间/min | 0 | 10 | 20 | 40 | 50 | 60 |
n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 | 0.10 |
(4)恒温恒容情况下,下列叙述能说明此反应达到平衡状态的是_______________。
a.混合气体的平均相对分子质量保持不变 b.CO2和H2的体积分数比为1﹕4
c.混合气体的密度保持不变 d.1mol CO2生成的同时有4mol H-H键断裂