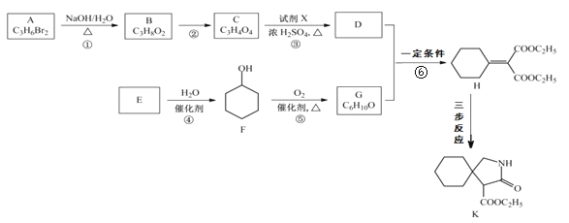
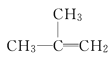
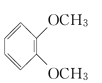
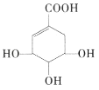
题目内容
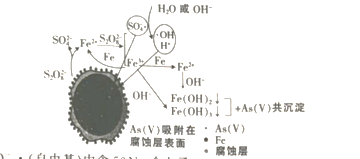
【题目】《环境科学》曾刊发我国科研部门采用零价铁活化过硫酸钠(Na2S2O7其中S为+6价)去除废水中的正五价砷的研究成果,其反应机理模型如图,(NA为阿伏加德罗常数的值)下列说法正确的是
A.1 molSO4-· (自由基)中含50NA个电子
B.pH越大,越不利于去除废水中的正五价砷
C.1 mol过硫酸钠中含NA个过氧键
D.转化过程中,若共有1 mol S2O82-被还原,则参加反应的Fe为56 g
【答案】C
【解析】
A. 1 mol SO4(自由基)中含1 mol×(16+4×8+1)NAmol1=49NA个电子,故A错误;
B. 室温下,pH越大,亚铁离子和铁离子变为氢氧化亚铁和氢氧化铁,越有利于去除废水中的+5价砷,故B错误;
C. 过硫酸钠(Na2S2O8)中S为+6价,Na为+1价,假设含有x个O2,含有y个O22,则x + 2y = 8,(+1) ×2+ (+6) ×2 + ( 2)×x+( 2)×y =0,则x =6,y=1,因此1mol过硫酸钠(Na2S2O8)含NA个过氧键,故C正确;
D. 根据图示可知,1mol Fe和1mol S2O82反应生成2mol SO42和1mol Fe2+,该过程转移2mol电子,但是1mol Fe2+还要与0.5mol S2O82反应变成Fe3+,因此1mol铁参加反应要消耗1.5mol S2O82,所以共有1 mol S2O82被还原时,参加反应的Fe![]() ,故D错误。
,故D错误。
综上所述,答案为C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】汽车排放的尾气为大气污染物之一,目前,可利用以下化学原理处理汽车尾气:2NO+2CO![]() 2CO2+N2。
2CO2+N2。
(1)写出CO2的结构式____________。
(2)一定条件下,在容积固定的容器中进行上述反应,CO浓度与时间关系如图所示:
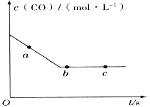
则反应速率v(a)、v(b)、v(c)的大小关系是_______。
(3)为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究。
(资料查阅)A.不同的催化剂对同一反应的催化效率不同;
B.使用等质量相同的催化剂时,催化剂的比表面积对催化效率有影响。
(实验设计)课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验:
实验编号 | 实验目的 | T/℃ | NO初始浓度/(mol/L) | CO初始浓度/(mol/L) | 同种催化剂的比表面积/(m2/g) | c(CO)不变时所用的时间/min |
Ⅰ | 参照实验 | 280 | 6.50×10-5 | 4.00×10-3 | 80 | t |
Ⅱ | 280 | 6.50×10-3 | 4.00×10-3 | 120 | 0.5t | |
Ⅲ | 360 | 6.50×10-3 | 4.00×10-3 | 80 | 0.2t |
(结论)
① 实验编号Ⅱ的实验目的为______________。
② 课题中探究外界条件对汽车尾气转化反应速率的影响的另一因素是_______, 且______反应速率将_______(填“增大”“减小”或“无影响”)。
【题目】蕴藏在海底的大量“可燃冰”,其开发利用是当前解决能源危机的重要课题。CH4(g)+2H2O(g)![]() CO2(g)+4H2(g) ΔH3 = +a kJ·mol-1
CO2(g)+4H2(g) ΔH3 = +a kJ·mol-1
化学键 | C—H | H—H | H—O |
键能kJ/mol | b | c | d |
(1)写出甲烷的结构式___________
(2)C=O的键能为_______________kJ/mol (用含a、b、c、d的式子表示)
(3)恒温条件下,在体积恒为0.5L的密闭容器中通入一定量甲烷和水蒸气,发生上述反应。测得甲烷物质的量随时间变化如下表所示。0~10min内用H2O的浓度表示该反应的平均速率为ν(H2O)= _____________
时间/min | 0 | 10 | 20 | 40 | 50 | 60 |
n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 | 0.10 |
(4)恒温恒容情况下,下列叙述能说明此反应达到平衡状态的是_______________。
a.混合气体的平均相对分子质量保持不变 b.CO2和H2的体积分数比为1﹕4
c.混合气体的密度保持不变 d.1mol CO2生成的同时有4mol H-H键断裂