题目内容
【题目】铜的相关化合物在生产生活中具有重要的作用。
回答下列问题:
(1)铜元素在周期表中的位置是____,基态铜原子中,核外电子占据最高能层的符号是___,占据该最高能层的电子数为_________。
(2)在一定条件下,金属相互化合形成的化合物称为金属互化物,如Cu9Al4、Cu6Zn8等。某金属互化物具有自范性,原子在三维空间里呈周期性有序排列,该金属互化物属于___(填“晶体”或”非晶体”)。
(3)铜能与类卤素[(SCN)2]反应生成Cu(SCN)2,1mol(SCN)2分子中含有σ键的数目为_____。
(SCN)2对应的酸有硫氰酸(H-S-C≡N)、异硫氰酸(H-N=C=S)两种,理论上前者沸点低于后者,其原因是__________。
(4)铜晶体中铜原子的堆积方式为面心立方堆积,每个铜原子周围距离最近的铜原子个数为__。
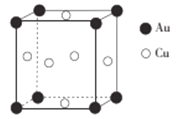
(5)铜与金形成的金属互化物的晶胞结构如图所示,其晶胞边长为anm,该金属互化物的密度为_____________(用含a、NA的代数式表示)g/cm3。
【答案】 第四周期IB族 N 1 晶体 5NA(或5×6.02×1023) 异硫氰酸分子间可形成氢鍵,而硫氰酸不能 12 3.89×1023/(a3NA)
【解析】分析:(1)根据Cu的原子结构示意图和核外电子排布式确定Cu在周期表中的位置、最高能层的符号和最高能层的电子数。
(2)根据晶体和非晶体的本质差异判断,晶体具有自范性、原子在三维空间呈周期性有序排列。
(3)(SCN)2的结构式为N![]() C—S—S—C
C—S—S—C![]() N,单键全为σ键,三键中有1个σ键和2个π键;异硫氰酸分子间形成氢键,沸点较高。
N,单键全为σ键,三键中有1个σ键和2个π键;异硫氰酸分子间形成氢键,沸点较高。
(4)铜原子的堆积方式为面心立方堆积,晶胞中Cu位于8个顶点和6个面心,以顶点Cu原子为研究对象,与之等距离最近的原子处于面心,顶点为8个晶胞共用,面心为2个晶胞共用,则每个铜原子周围距离最近的铜原子个数为![]() =12。
=12。
(5)用“均摊法”确定晶胞中原子个数和化学式,由晶胞边长计算晶胞体积,计算1mol晶体的体积和质量,1mol晶体的质量除以1mol晶体的体积得出晶体的密度。
详解:(1)Cu原子核外有29个电子,Cu原子结构示意图为![]() ,基态Cu原子的核外电子排布式为1s22s22p63s23p63d104s1,Cu在元素周期表中位于第四周期IB族。基态Cu原子中,核外电子占据最高能层是第四能层,第四能层的符号是N。占据该最高能层的电子数为1。
,基态Cu原子的核外电子排布式为1s22s22p63s23p63d104s1,Cu在元素周期表中位于第四周期IB族。基态Cu原子中,核外电子占据最高能层是第四能层,第四能层的符号是N。占据该最高能层的电子数为1。
(2)某金属互化物具有自范性,原子在三维空间里呈周期性有序排列,该金属互化物属于晶体。
(3)(SCN)2的结构式为N![]() C—S—S—C
C—S—S—C![]() N,单键全为σ键,三键中有1个σ键和2个π键,1个(SCN)2中含5个σ键,1mol(SCN)2分子中含有5molσ键,含σ键的数目为5NA。异硫氰酸分子间形成氢键,硫氰酸分子间不存在氢键,硫氰酸的沸点低于异硫氰酸。
N,单键全为σ键,三键中有1个σ键和2个π键,1个(SCN)2中含5个σ键,1mol(SCN)2分子中含有5molσ键,含σ键的数目为5NA。异硫氰酸分子间形成氢键,硫氰酸分子间不存在氢键,硫氰酸的沸点低于异硫氰酸。
(4)铜晶体中铜原子的堆积方式为面心立方堆积,晶胞中Cu位于8个顶点和6个面心,以顶点Cu原子为研究对象,与之等距离最近的原子处于面心,顶点为8个晶胞共用,面心为2个晶胞共用,则每个铜原子周围距离最近的铜原子个数为![]() =12。
=12。
(5)用“均摊法”,1个晶胞中含Au:8![]() =1个,Cu:6
=1个,Cu:6![]() =3个,金属互化物的化学式为Cu3Au;1个晶胞的体积为(a
=3个,金属互化物的化学式为Cu3Au;1个晶胞的体积为(a![]() 10-7cm)3=a3
10-7cm)3=a3![]() 10-21cm3,1mol晶体的体积为a3
10-21cm3,1mol晶体的体积为a3![]() 10-21cm3
10-21cm3![]() NA=a3
NA=a3![]() NA
NA![]() 10-21cm3,1mol晶体的质量为389g,该金属互化物的密度为389g
10-21cm3,1mol晶体的质量为389g,该金属互化物的密度为389g![]() (a3
(a3![]() NA
NA![]() 10-21cm3)=
10-21cm3)=![]() g/cm3。
g/cm3。



