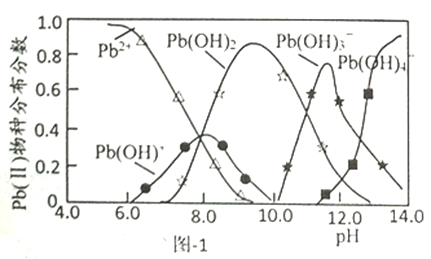
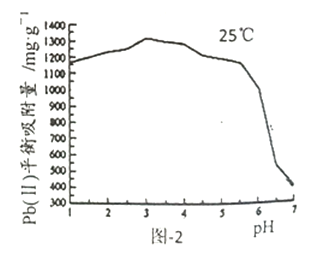
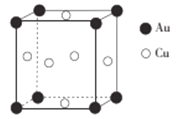
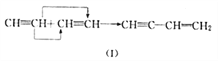
题目内容
【题目】(1)根据元素周期律,碳的非金属性强于硅,请用一个化学反应方程式表示___________________。
(2)若FeSO4和O2的系数比为2∶1,试配平下列方程式:
![]() FeSO4+
FeSO4+![]() K2O2→
K2O2→![]() K2FeO4+
K2FeO4+![]() K2O+
K2O+![]() K2SO4+
K2SO4+![]() O2↑ __________________
O2↑ __________________
(3)各种氮氧化物(NO、NO2)是主要的大气污染物之一,治理氮氧化物(NOx)废气的方法之一是用NaOH溶液进行吸收,现有NO与NO2的混合气体,将其通入50 mL 2 mol/L的NaOH溶液中,恰好完全吸收,测得溶液中含有NO3- 0.02 mol。
①所得溶液中NaNO2的物质的量为________ mol;
②混合气体中V(NO)∶V(NO2)=________。
(4)As2O3俗称砒霜,As2O3是两性偏酸性氧化物,是亚砷酸(H3AsO3)的酸酐,易溶于碱生成亚砷酸盐,写出As2O3与足量氢氧化钠溶液反应的离子方程式___________。
【答案】CO2+Na2SiO3+H2O=Na2CO3+H2SiO3↓ 2 6 2 2 2 1 0.08 3∶7 As2O3+6OH-=2AsO33-+3H2O
【解析】
(1)非金属性越强,最高价氧化物对应的水化物的酸性越强,根据强酸制弱酸设计反应原理。
(2)根据得失电子数相等配平化学方程式。
(3)①根据Na元素质量守恒来计算即可。②根据NaNO2和NaNO3的物质的量,利用反应的化学方程式解答即可。
(4)两性氧化物与碱反应生成盐和水。
(1)非金属性越强,最高价氧化物对应的水化物的酸性越强,利用CO2+Na2SiO3+H2O=Na2CO3+H2SiO3↓可知,碳酸的酸性大于硅酸,即C的非金属性比Si强。
(2) FeSO4中Fe的化合价为+2价,K2FeO4中Fe的化合价为+6价,所以一个FeSO4失去4个电子;K2O2中O的化合价为-1价,O2中O的化合价为0价,一个K2O2失去2个电子生成O2;K2O2中O的化合价为-1价,K2FeO4和K2O中O的化合价为-2价,所以每个K2O2得到2个电子,由FeSO4和O2的系数比为2∶1可知一共失去10个电子,那么需要5个K2O2得到电子,1个K2O2失去电子,即K2O2的系数为6,然后再根据原子种类和数目不变配平其他物质的系数,即为2FeSO4+6K2O2=2K2FeO4+2K2O+2K2SO4+O2↑。
(3)①n(NaNO3)=n(NO3-)=0.02mol,n(NaOH)=0.05L×2mol/L=0.1mol,根据Na元素质量守恒,则n(NaOH)=n(NaNO3)+n(NaNO2),n(NaNO2)=0.1mol-0.02mol=0.08mol,故答案为:0.08。
②设混合物中NO的物质的量为x mol,NO2的物质的量为y mol,
NO2+NO+2NaOH=2NaNO2+H2O
1 1 2
x x 2x
2NO2+2NaOH= NaNO2 + NaNO3 + H2O
2 1 1
y-x ![]() ( y-x)
( y-x) ![]() ( y-x)
( y-x)
2x+![]() ( y-x)=0.08,
( y-x)=0.08,![]() ( y-x)=0.002,解得x=0.03,y=0.07。在相同条件下物质的量之比等于体积之比,混合气体中V(NO)∶V(NO2)=3∶7。
( y-x)=0.002,解得x=0.03,y=0.07。在相同条件下物质的量之比等于体积之比,混合气体中V(NO)∶V(NO2)=3∶7。
(4)As2O3与足量氢氧化钠溶液反应生成亚砷酸钠和水,反应的离子方程式为:As2O3+6OH-=2AsO33-+3H2O