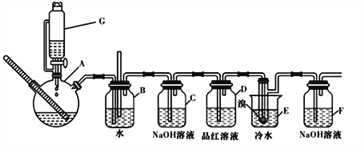
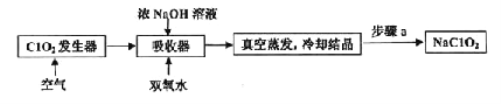
题目内容
【题目】常温下,H2A是一种易溶于水的二元酸,将NaOH溶液滴入等物质的量浓度的H2A溶液中,溶液中H2A、HA-、A2-的物质的量分数(a)随溶液pH的变化关系如图所示。下列说法错误的是

A. 常温下,H2A![]() HA-+H+的电离平衡常数Ka1=10-3.30
HA-+H+的电离平衡常数Ka1=10-3.30
B. 当c(Na+)=2c(A2-)+c(HA-)时,溶液呈中性
C. pH=6.27时,c(A2-)=c(HA-)>c(H+)>c(OH-)
D. V(NaOH溶液):V(HA溶液)=3:2时,2c(Na+)+c(OH-)=2c(H2A)+c(HA-)+c(H+)
【答案】D
【解析】分析:A项,根据电离平衡常数表达式和点(3.30,0.5)计算Ka1;B项,根据电荷守恒判断;C项,根据点(6.27,0.5)和图像判断;D项,用电荷守恒、物料守恒判断。
详解:A项,H2A![]() H++HA-的电离平衡常数Ka1=
H++HA-的电离平衡常数Ka1=![]() ,当c(HA-)=c(H2A)时溶液的pH=3.30即溶液中c(H+)=10-3.30,代入Ka1=10-3.30,A项正确;B项,NaOH滴入H2A溶液中,溶液中的电荷守恒为c(Na+)+c(H+)=c(HA-)+2c(A2-)+c(OH-),当c(Na+)=c(HA-)+2c(A2-)时,c(H+)=c(OH-),溶液呈中性,B项正确;C项,根据图像pH=6.27时,溶液中c(A2-)=c(HA-),溶液呈酸性,c(H+)
,当c(HA-)=c(H2A)时溶液的pH=3.30即溶液中c(H+)=10-3.30,代入Ka1=10-3.30,A项正确;B项,NaOH滴入H2A溶液中,溶液中的电荷守恒为c(Na+)+c(H+)=c(HA-)+2c(A2-)+c(OH-),当c(Na+)=c(HA-)+2c(A2-)时,c(H+)=c(OH-),溶液呈中性,B项正确;C项,根据图像pH=6.27时,溶液中c(A2-)=c(HA-),溶液呈酸性,c(H+)![]() c(OH-),C项正确;D项,NaOH滴入H2A溶液中,溶液中的电荷守恒为c(Na+)+c(H+)=c(HA-)+2c(A2-)+c(OH-),NaOH溶液和H2A溶液物质的量浓度相等,当V(NaOH溶液):V(H2A溶液)=3:2时,溶液中的物料守恒为2c(Na+)=3[c(H2A)+c(HA-)+c(A2-)],将两式整理得,
c(OH-),C项正确;D项,NaOH滴入H2A溶液中,溶液中的电荷守恒为c(Na+)+c(H+)=c(HA-)+2c(A2-)+c(OH-),NaOH溶液和H2A溶液物质的量浓度相等,当V(NaOH溶液):V(H2A溶液)=3:2时,溶液中的物料守恒为2c(Na+)=3[c(H2A)+c(HA-)+c(A2-)],将两式整理得, ![]() c(Na+)+c(OH-)=2c(H2A)+c(HA-)+c(H+),D项错误;答案选D。
c(Na+)+c(OH-)=2c(H2A)+c(HA-)+c(H+),D项错误;答案选D。

【题目】由CH3CH2CH2Br制备CH3CH(OH)CH2OH,依次发生的反应类型和反应条件都正确的是
选项 | 反应类型 | 反应条件 |
A | 加成、取代、消去 | KOH醇溶液/加热、KOH水溶液/加热、常温 |
B | 消去、加成、取代 | NaOH醇溶液/加热、常温、KOH水溶液/加热 |
C | 氧化、取代、消去 | 加热、KOH醇溶液/加热、KOH水溶液/加热 |
D | 消去、加成、水解 | NaOH水溶液/加热、常温、NaOH醇溶液/加热 |
A. A B. B C. C D. D