题目内容
【题目】下列关于原电池的叙述中,正确的是( )
A.原电池的负极上发生还原反应
B.原电池工作时,电子总是由负极经导线流入正极
C.原电池中,正、负极的电极材料一定都是金属单质
D.酸碱中和反应也可以设计成原电池
【答案】B
【解析】
A.原电池工作时,负极上失电子,发生氧化反应,A不正确;
B.原电池工作时,电子总是由负极出发,沿着导线流向正极,B正确;
C.原电池中,通常负极材料为金属单质,但正极的电极材料不一定是金属单质如石墨等,C不正确;
D.酸碱中和反应属于非氧化还原反应,不能设计成原电池,D不正确;
故选B。

 阅读快车系列答案
阅读快车系列答案【题目】O2、O3、N2、N4是氧和氮元素的几种单质。回答下列问题:
(1)O原子中价电子占据的轨道数目为__________________。
(2)第一电离能I1:N____O(填“>”或“<”),第二电离能I2:O大于N的原因是__________________。
(3)O3的空间构型为_________________;是_____________(填“极性”或“非极性”)分子;分子中存在的大π键,可用符号![]() 表示,其中m表示形成的大π键的原子数,n表示形成的大π键的电子数,则O3中大π键应表示为_______________________。
表示,其中m表示形成的大π键的原子数,n表示形成的大π键的电子数,则O3中大π键应表示为_______________________。
(4)N元素的简单气态氢化物NH3在H2O中溶解度很大,其原因之一是NH3和H2O可以形成分子间氢键,则在氨水中氢键可以表示为H3N…H-N、___________、____________ (任写两种即可)。
(5)已知:如下键能和键长数目。
化学键 | 键长/pm | 键能/ |
N-N | 145 | 193 |
N=N | 125 | 418 |
N | 110 | 946 |
N2和N4都是N元素的单质,其中N4是正面体构型,N原子占据四面体的四个顶点,从键参数角度分析N4分子稳定性远小于N2原因是________________________________________。
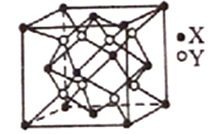
(6)Na2O的晶胞结构如下图所示,X表示O2-,Y表示Na+,则O2-的配位数为_______________,该晶胞的原子空间利用率为_______________;(已知该晶胞的棱长为apm,r(Na+)=xpm,r(O2-)=ypm)。