题目内容
【题目】一定条件下,体积为2L的密闭容器中,1mol X和3mol Y进行反应:X(g)+3Y(g)2Z(g),经12s达到平衡,生成0.6mol Z.下列说法正确的是( )
A.以X浓度变化表示的反应速率为 ![]() mol(Ls)
mol(Ls)
B.12s后将容器体积扩大为10L,Z的平衡浓度变为原来的 ![]()
C.若增大X的浓度,则物质Y的转化率减小
D.若该反应的△H<0,升高温度,平衡常数K减小
【答案】D
【解析】解:一定条件下,体积为2L的密闭容器中,1molX和3molY进行反应:X(g)+3Y(g)2Z(g),经12s达到平衡,生成0.6molZ.依据化学平衡三段式列式计算为:
X(g)+ | 3Y(g) | 2Z(g) | |
起始(mol) | 1 | 3 | 0 |
转化(mol) | 0.3 | 0.9 | 0.6 |
平衡(mol) | 0.7 | 2.1 | 0.6 |
A、以X浓度变化表示的反应速率为 ![]() =
= ![]() mol(Ls),故A错误;
mol(Ls),故A错误;
B、12s后将容器体积扩大为10L,体积变化Z的浓度变为原来的 ![]() ,为0.06mol/L,但减小压强平衡逆向进行,Z的平衡浓度小于0.06mol/L,故B错误;
,为0.06mol/L,但减小压强平衡逆向进行,Z的平衡浓度小于0.06mol/L,故B错误;
C、若增大X的浓度,则物质Y的转化率增大,故C错误;
D、若该反应的△H<0,升高温度,平衡向吸热反应方向进行,平衡逆向进行,平衡常数K减小,故D正确;
故选D.
【考点精析】解答此题的关键在于理解化学平衡状态本质及特征的相关知识,掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效),以及对化学平衡的计算的理解,了解反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.

【题目】NH3作为重要化工原料,被大量应用于工业生产,与其有关性质反应的催化剂研究曾被列入国家863计划。
(1)氨的催化氧化反应:4 NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H< 0,是制硝酸的基础反应,在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:
4NO(g)+6H2O(g) △H< 0,是制硝酸的基础反应,在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:
浓度 时间 | C(NH3) mol/L | C(O2) mol/L | C(NO) mol/L |
第0 min | 0.8 | 1.6 | 0 |
第1 min | a | 1.35 | 0.2 |
第2 min | 0.3 | 0.975 | 0.5 |
第3 min | 0.3 | 0.975 | 0.5 |
第4 min | 0.7 | 1.475 | 0.1 |
①反应在第1min到第2min时,NH3的平均反应速率为______________。
②反应在第3 min时改变了条件,改变的条件可能是___________(填序号)。
A.使用催化剂 B.减小压强 C.升高温度 D.增加O2的浓度
③说明4NH3(g)+5O2(g)![]() 4NO(g)+6 H2O(g)达到平衡状态的是____(填序号)。
4NO(g)+6 H2O(g)达到平衡状态的是____(填序号)。
A.单位时间内生成n mol NO的同时生成n mol NH3
B.百分含量w(NH3)=w(NO)
C.反应速率v(NH3):v(O2):v(NO):v(H2O)=4:5:4:6
D.在恒温恒容的容器中,混合气体的平均相对分子质量不再变化
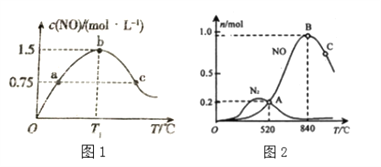
(2)若在容积为2L的密闭容器中充入4.0molNH3(g)和5.0molO2(g),发生如下反应:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),保持其他条件不变,在相同的时间内测得c(NO)与温度的关系如下图1所示。则 T1℃下,NH3的平衡转化率为______。
4NO(g)+6H2O(g),保持其他条件不变,在相同的时间内测得c(NO)与温度的关系如下图1所示。则 T1℃下,NH3的平衡转化率为______。
(3)氨催化氧化时会发生两个竞争反应,分别为
反应I:4NH![]() 4NO(g) +6H2O(g) △H= -905.0 kJ·mol-1
4NO(g) +6H2O(g) △H= -905.0 kJ·mol-1
反应II: 4NH3(g)+3O2(g)![]() 2N2(g) +6H2O(g) △H= -1266.6 kJ·mol-1。
2N2(g) +6H2O(g) △H= -1266.6 kJ·mol-1。
为分析某催化剂对该反应的选择性,在1L密闭容器中充入1 mol NH3和2mol O2,测得有关物质的量关系如上图2:
①该催化剂在低温时选择反应_______(填“ I ”或“ II”)。
②C点比B点所产生的NO的物质的量少的主要原因______________________________。(4)通过以上两个竞争反应写出NO分解生成N2与O2的热化学方程式________________。




