题目内容
【题目】有关如图所示原电池的叙述,正确的是(盐桥中装有含琼胶的KCl饱和溶液)( )
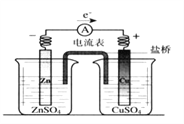
A. 铜片上有气泡逸出
B. 取出盐桥后,电流计依然发生偏转
C. 反应中,盐桥中的K+会移向CuSO4溶液
D. 反应前后铜片质量不改变
【答案】C
【解析】分析:该装置为原电池装置,Zn为负极,发生氧化反应Zn-2e-=Zn2+,Cu为正极,发生还原反应Cu2++2e-=Cu,原电池工作时,阳离子向正极移动,阴离子向负极移动,以此解答该题。
详解:A.该原电池中,铜作正极,正极上铜离子得电子生成铜单质,所以铜片上没有气泡产生,A错误;
B.取出盐桥后,不是闭合回路,没有电流产生,电流计不发生偏转,B错误;
C.原电池放电时,盐桥中阳离子向正极移动,所以盐桥中钾离子向硫酸铜溶液移动,C正确;
D.铜电极上铜离子得电子发生还原反应而析出铜,所以铜片质量增加,D错误;答案选C。

练习册系列答案
相关题目
