题目内容
1.已知H3PO4为弱酸,常温下NaH2PO4溶液的pH小于7.下列关于常温下0.10mol•L-1的NaH2PO4溶液的说法正确的是( )| A. | c(Na+)=c(H2PO4-)+c(HPO42-)+C(H3PO4) | |
| B. | c(Na+)+c(H+)=c(OH-)+c(H2PO4-)+2c(HPO42-)+3c(PO43-) | |
| C. | 温度升高,c(H2PO4-)增大 | |
| D. | 加水稀释后,m(H+)与m(OH-)的乘积不变 |
分析 常温下NaH2PO4溶液的pH小于7,说明H2PO4-的水解程度小于其电离程度,
A.溶液中一定满足物料守恒,根据NaH2PO4溶液中的物料守恒分析;
B.溶液中一定满足电荷守恒,根据NaH2PO4溶液中的电荷守恒判断;
C.升高温度,促进了H2PO4-的电离,溶液中H2PO4-的浓度减小;
D.稀释过程中,H2PO4-的电离程度增大,溶液中氢离子的物质的量增大,但是溶液中氢离子浓度减小,而水的离子积不变,则氢氧根离子浓度增大,氢氧根离子的物质的量、质量增大.
解答 解:A.根据NaH2PO4溶液中的物料守恒可得:c(Na+)=c(H2PO4-)+c(PO43-)+c(HPO42-)+c(H3PO4),故A错误;
B.根据NaH2PO4溶液中的电荷守恒可得:c(Na+)+c(H+)=c(OH-)+c(H2PO4-)+2c(HPO42-)+3c(PO43-),故B正确;
C.温度升高,H2PO4-的电离程度增大,则溶液中c(H2PO4-)减小,故C错误;
D.加水稀释后,H2PO4-的电离程度增大,溶液中氢离子的物质的量增大,则氢离子的质量增大;由于溶液中氢离子浓度减小,而水的离子积不变,则氢氧根离子浓度增大,氢氧根离子的物质的量、质量增大,故m(H+)与m(OH-)的乘积会增大,故D错误;
故选B.
点评 本题考查了离子浓度大小比较,题目难度中等,明确盐的水解原理及其影响为解答关键,注意掌握电荷守恒、物料守恒在判断离子浓度大小中的应用.

练习册系列答案
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
11.一定量的CuS投入足量的HNO3中,收集到标准状况下的气体VL,向反应后的溶液中加入足量的NaOH,产生蓝色沉淀,经过滤、洗涤、灼烧,得到CuO12g,若上述气体为NO和NO2的混合物,且体积比为1:1,则V为( )
| A. | 9.0L | B. | 13.44L | C. | 15.7L | D. | 16.8L |
12.利用图所示装置进行下列实验,能得出相应实验结论的是( )
| 选项 | ① | ② | ③ | 实验结论 | 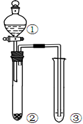 |
| A | 稀硫酸 | Na2CO3 | C6H5ONa | 酸性:H2CO3>C6H5OH | |
| B | 液溴和苯 | 铁屑 | AgNO3溶液 | 液溴和苯发生取代反应 | |
| C | 稀盐酸 | Na2SO3 | Ba(NO3)2溶液 | SO2与可溶性钡盐可以生成白色沉淀 | |
| D | 浓盐酸 | KMnO4 | FeBr2溶液 | 氧化性:Cl2>Br2>Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
9.下列物质中,加入水中显著放热并且生成碱的是( )
| A. | 生石灰 | B. | 食盐 | C. | 浓硫酸 | D. | 硝酸铵 |
16.某学生将电流表用导线与两个电极连接在一起,再将两个电极同时插入某种电解质溶液中,能观察到有电流产生的是( )
| A. | 用铜片、铅笔芯作电极插入稀硫酸中 | |
| B. | 用两个铜片作电极插入硝酸银溶液中 | |
| C. | 用锌片、铜片作电极插入番茄中 | |
| D. | 用铜片、铁片作电极插入酒精中 |
6.下列装置中能将电能转化为化学能的是( )
| A. |  | B. |  | C. | 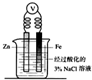 | D. | 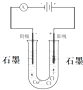 |
13.硒(Se)与硫在元素周期表中位于同一主族.下列说法不正确的是( )
| A. | 原子半径:Se>S | B. | 沸点:H2S>H2Se | ||
| C. | 稳定性:H2S>H2Se | D. | 酸性:H2SO4>H2SeO4 |
10.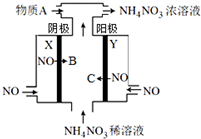 电解NO制备 NH4NO3的工作原理如图所示,X、Y皆为Pt电极,为使电解产物全部转化为NH4NO3,需补充物质A.下列说法正确的是( )
电解NO制备 NH4NO3的工作原理如图所示,X、Y皆为Pt电极,为使电解产物全部转化为NH4NO3,需补充物质A.下列说法正确的是( )
 电解NO制备 NH4NO3的工作原理如图所示,X、Y皆为Pt电极,为使电解产物全部转化为NH4NO3,需补充物质A.下列说法正确的是( )
电解NO制备 NH4NO3的工作原理如图所示,X、Y皆为Pt电极,为使电解产物全部转化为NH4NO3,需补充物质A.下列说法正确的是( )| A. | 在阴极NO转化为B,B为硝酸根离子 | |
| B. | 电解一段时间,阴极附近pH升高 | |
| C. | 为使电解产物全部转化为NH4NO3,需补充的A为硝酸 | |
| D. | 该电解池的阳极反应式为:NO-3e-+4OH-=NO${\;}_{3}^{-}$+2H2O |
11.金属材料的发展在人类文明发展中起着巨大的作用.下列金属中用电解方法进行冶炼的是( )
| A. | 铝 | B. | 铜 | C. | 银 | D. | 铁 |