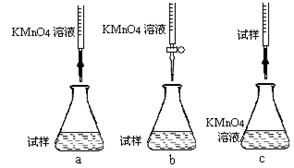
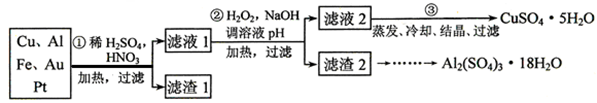
题目内容
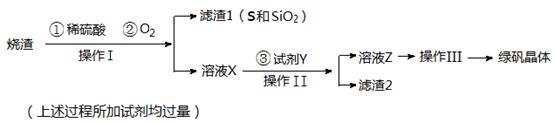
绿矾(FeSO4·7H2O)可用于色谱分析剂、净水、照相制版等方面。下面是以铁屑(含少量锡等杂质)生产绿矾的一种方法: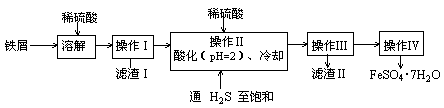
己知:在H2S饱和溶液中,SnS沉淀完全时的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时溶液的pH为5.5。
(1)操作Ⅱ中用pH试纸测定溶液pH的操作是:
(2)操作Ⅱ中用硫酸酸化至pH=2的目的是
(3)操作Ⅲ中需要的玻璃仪器是烧杯、 。
(4)通入硫化氢至饱和的目的是:①除去操作Ⅰ所得溶液中含有的Sn2+等杂质离子;
②
(5)操作IV的顺序依次为: 、冷却结晶、 。
(6)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;② 。
(1)将pH试纸放在干净、干燥的表面皿上,用干净、干燥的玻璃棒蘸取少量待测液滴在pH试纸中间,观察颜色并与比色卡比较
(2)使溶液中的Sn2+完全转化为SnS,而Fe2+不生成FeS沉淀
(3)玻璃棒、漏斗
(4)将溶液中的Fe3+离子转化为Fe2+离子
(5)蒸发浓缩 过滤 (6)降低绿矾的溶解度,减少绿矾的损失
解析试题分析:工艺流程题的关键是搞清楚加入什么物质,发生什么反应,如何分离。开始铁屑(Sn)加入硫酸溶解,转化为FeSO4、SnSO4等和不溶性杂质,通过过滤的方法将不溶性杂质除去;然后根据已知条件可知,调节pH在1.6~3.0,锡转化为SnS沉淀,而Fe2+在溶液中,从而通过过滤方法进行分离;FeSO4溶液,通过蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到FeSO4·7H2O晶体。
考点:本题以工艺流程为基础,考查元素及化合物性质、化学实验基本操作等相关知识。

 一诺书业暑假作业快乐假期云南美术出版社系列答案
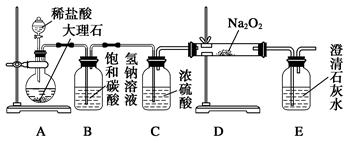
一诺书业暑假作业快乐假期云南美术出版社系列答案现有含CaO杂质的CaC2试样。某研究性学习小组的同学拟用以下三种方案测定CaC2试样的纯度。请填写下列空白:
(1)第一种方案:请从下图中选用适当的装置,设计一个实验,测定CaC2试样的纯度。
所选用装置的连接顺序为(填各接口的字母): 。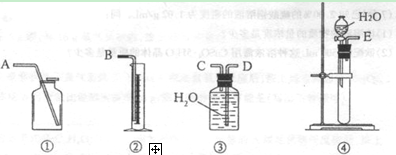
(2)第二种方案:根据试样和水在锥形瓶中反应前后质量的变化,测定CaC2的质量分数。先称取试样1.50g,并称量锥形瓶和水的质量为195.00g,再将试样加入锥形瓶中,反应过程中每隔相同时间测得的数据如下表。
| | 读数次数 | 质量/g |
| 锥形瓶+水+试样 | 第1次 | 196.30 |
| 第2次 | 196.15 | |
| 第3次 | 196.05 | |
| 第4次 | 196.00 | |
| 第5次 | 196.00 |
①计算CaC2的质量分数时,不必作第6次读数的原因是: 。
②此试样中CaC2的质量分数为 。(保留2位有效数字)
(3)第三种方案:称取一定质量的试样(1.60g),操作流程如下:

①操作Ⅱ的名称是 。
②在转移溶液时,如溶液转移不完全,则CaC2质量分数的测定结果 (填“偏大”、“偏小”或“不变”)。
下列实验能达到目的的是
| A.只滴加氨水鉴别NaCl、AlCl3、MgCl2、Na2SO4四种溶液 |
| B.将NH4Cl溶液蒸干制备NH4Cl固体 |
| C.用可见光束照射以区别溶液和胶体 |
| D.用萃取分液的方法除去酒精中的水 |
下列除杂质的方法中正确的是( )
| A.乙醇中混有乙酸,加入NaOH溶液后,用分液漏斗分液 |
| B.乙烷中混有乙烯,通入H2,在一定条件下反应使乙烯完全转化成乙烷 |
| C.苯甲醛中混有苯甲酸,加入生石灰后,再加热蒸馏 |
| D.溴苯中含有单质溴加入KI溶液后用分液漏斗分液 |
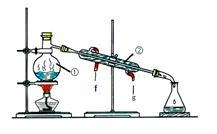
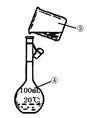
 试回答:
试回答: