题目内容
【题目】电镀广泛地应用于工业生产中。在电镀铬的工业废水中主要含有Cr3+,同时还含有少量的Cu2+、Fe2+、Fe3+和Al3+等,且酸性较强。为回收利用铬元素,此工业废水通常采用如下流程处理:

已知:
(1) 铬元素有以下循环过程:

(2) Cu(OH)2能溶于氨水:Cu(OH)2+4NH3H2O=[Cu(NH3)4]2++2OH-+4H2O
请回答下列问题:
(1)加入试剂甲的目的:__________;
(2)试剂乙的名称:___________,试剂丙的化学式:_________;
(3) 上述操作I、Ⅱ、Ⅲ相同,则进行该实验操作所需要的主要玻璃仪器有________;
(4)滤渣I的主要成分为__________(写化学式)。
(5)在铬元素循环过程的反应①中每反应掉1 mol H2O2同时消耗H+数目为:__________;
(6) 铬元素循环过程的反应⑥的离子方程式______________;废水处理流程中生成滤渣Ⅲ的离子方程式________。
【答案】将Fe2+氧化成Fe3+ 氨水 Cl2 烧杯、漏斗、玻璃棒 Cu(OH)2、Fe(OH)3 ![]() ×6.02×1023 2CrO42-+2H+Cr2O72-+H2O 2H2O+A1O2-+CO2=Al(OH)3↓+HCO3-
×6.02×1023 2CrO42-+2H+Cr2O72-+H2O 2H2O+A1O2-+CO2=Al(OH)3↓+HCO3-
【解析】
(1)根据废水的成分和加入试剂甲以后废水的成分来回答;
(2)试剂乙可以将氢氧化铜沉淀溶解掉;试剂丙可以将CrO2-转化为CrO42-;
(3)根据实验的目的判断实验操作,据此分析判断所需要的主要玻璃仪器;
(4)根据氢氧化钠和各个离子之间的反应以及反应的产物来回答;
(5)根据重铬酸根和双氧水在酸性环境下的反应来回答;
(6)反应⑥为铬酸根在酸性条件下可以转化为重铬酸根;向四羟基合铝酸根中通入过量二氧化碳会生成滤渣Ⅲ。
(1)在电镀铬的工业废水中主要含有Cr3+,同时还含有少量的Cu2+、Fe2+、Fe3+和Al3+等,加入试剂甲以后废水的成分含有Cr3+、Cu2+、Fe3+和Al3+,由此可见试剂甲将亚铁离子氧化为三价铁离子,故答案为将Fe2+氧化成Fe3+;
(2)向含有Cr3+、Cu2+、Fe3+和Al3+的溶液中加入过量的氢氧化钠,生成的沉淀即滤渣Ⅰ有氢氧化铜和氢氧化铁,根据题意信息Cu(OH)2+4NH3H2O=[Cu(NH3)4]2++2OH-+4H2O,所以试剂乙可以将氢氧化铜沉淀溶解掉,应为氨水,根据铬元素的循环过程,可知试剂丙可以将CrO2-氧化为CrO42-,实现三价铬到CrO42-的转化,所以试剂丙是氯气,故答案为氨水;Cl2;
(3)操作I、Ⅱ、Ⅲ均实现了难溶固体和液体的分离,是过滤,过滤实验操作所需要的主要玻璃仪器有烧杯、漏斗、玻璃棒,故答案为烧杯、漏斗、玻璃棒;
(4)向含有Cr3+、Cu2+、Fe3+和Al3+的溶液中加入过量的氢氧化钠,生成的沉淀即滤渣Ⅰ有氢氧化铜和氢氧化铁,故答案为Cu(OH)2、Fe(OH)3;
(5)重铬酸根和双氧水在酸性环境下的反应实质是:Cr2O72-+3H2O2+8H+=7H2O+3O2↑+2Cr3+,每反应掉1molH2O2同时消耗H+的物质的量为![]() mol,数目为:
mol,数目为:![]() ×6.02×1023,故答案为
×6.02×1023,故答案为![]() ×6.02×1023;
×6.02×1023;
(6)反应⑥为铬酸根在酸性条件下可以转化为重铬酸根,即2CrO42-+2H+Cr2O72-+H2O;向四羟基合铝酸根中通入过量二氧化碳会生成氢氧化铝和碳酸氢钠,反应的离子方程式为2H2O+A1O2-+CO2=Al(OH)3↓+HCO3-,故答案为2CrO42-+2H+Cr2O72-+H2O;2H2O+A1O2-+CO2=Al(OH)3↓+HCO3-。

 高中必刷题系列答案
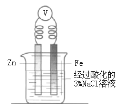
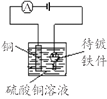
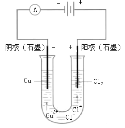
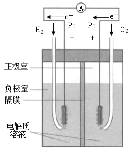
高中必刷题系列答案【题目】中学化学教材中,常借助于图像这一表现手段清晰地突出实验装置的要点、形象地阐述化学过程的原理。下列有关化学图像表现的内容不正确的是
选项 | A | B | C | D |
装置 |
|
|
|
|
原理 | 牺牲阳极的阴极保护法 | 电镀 | 电解CuCl2溶液 | 氢氧燃料电池 |
A.AB.BC.CD.D