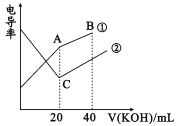
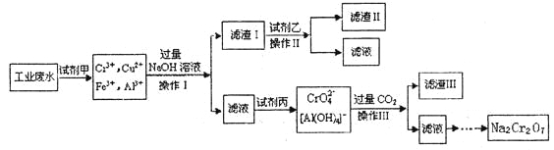
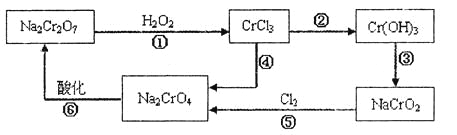
题目内容
【题目】Ⅰ.利用甲烷催化还原NOx消除氮氧化物的污染
①CH4(g)+4NO2(g) ![]() 4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1
4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1
②CH4(g)+4NO(g) ![]() 2N2(g)+CO2(g)+2H2O(g) ΔH2=-1 160 kJ·mol-1
2N2(g)+CO2(g)+2H2O(g) ΔH2=-1 160 kJ·mol-1
③CH4(g)+2NO2(g) ![]() N2(g)+CO2(g)+2H2O(g) ΔH3=-867 kJ·mol-1
N2(g)+CO2(g)+2H2O(g) ΔH3=-867 kJ·mol-1
(1)如果三个反应的平衡常数依次为K1、K2、K3,则K3=________(用K1、K2表示)。
(2)在2L恒容密闭容器中充入1 mol CH4和2 mol NO2进行反应③,CH4的平衡转化率α(CH4)与温度和压强的关系如图所示。
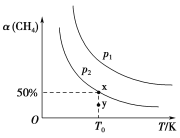
①若容器中的压强为p2,y点:v正________(填“大于”“等于”或“小于”)v逆。
②x点对应温度下反应的平衡常数K=________。
Ⅱ.甲烷蒸气转化法制H2的主要反应为:CH4(g)+H2O(g) ![]() CO(g)+3H2(g)
CO(g)+3H2(g)
(3)在恒容密闭容器中充入2 mol CH4和H2O(g)的混合气体,且CH4和H2O(g)的物质的量之比为x,相同温度下达到平衡时测得H2的体积分数φ(H2)与x的关系如图所示。
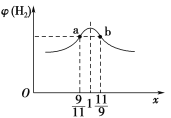
则CH4的转化率:a点________(填“>”“=”或“<”,下同)b点,CH4(g)的浓度:a点________b点,氢气的产率:a点________b点。
【答案】![]() 大于 0.25 > = =
大于 0.25 > = =
【解析】
Ⅰ.(1)分别写出K1、K2、K3的表达式,可以求出K3与K1、K2的关系;
(2)①y点在p2对应曲线下方,要达到平衡状态,需使甲烷的转化率增大,反应正向进行;
②结合题图1,根据三段式可以求出该温度下反应的平衡常数K;
Ⅱ.(3)x越大,加入的甲烷的量越多,因此甲烷的转化率越低;结合题给图像根据三段式进行分析判断;
Ⅰ.(1)K1=[c2(H2O)c(CO2)c4(NO)]/[c(CH4)c4(NO2)],K2=[c2(H2O)c(CO2)c2(N2)]/[c(CH4)c4(NO)],K3=[c2(H2O)c(CO2)c(N2)]/[c(CH4)c2(NO2)];所以K32= K1 K2,所以K3=![]() ;
;
答案是:![]() ;
;
(2)①y点在p2对应曲线下方,要达到平衡状态,需使甲烷的转化率增大,则y点:v正大于v逆;
答案是:大于;
②由题图1可知,x点甲烷的平衡转化率是50%,则有:
CH4(g)+2NO2(g) ![]() N2(g)+CO2(g)+2H2O(g)
N2(g)+CO2(g)+2H2O(g)
起始/(mol·L-1)0.5 1 0 0 0
转化/(mol·L-1)0.25 0.5 0.25 0.25 0.5
平衡/(mol·L-1)0.25 0.5 0.25 0.25 0.5
因此该温度下反应的平衡常数K=![]() =0.25;
=0.25;
答案是:0.25;
Ⅱ.(3)x越大,加入的甲烷的量越多,因此甲烷的转化率越低,故a点甲烷的转化率大于b点甲烷的转化率;当CH4和H2O(g)的物质的量之比的比值为9/11时,则起始时,甲烷的物质的量为0.9 mol,H2O(g)的物质的量为1.1 mol,反应达到平衡时,设CH4转化了n mol,则有:
CH4(g)+H2O(g)![]() CO(g)+3H2(g)
CO(g)+3H2(g)
起始/(mol) 0.9 1.1 0 0
转化/(mol) n n n 3n
平衡/(mol) 0.9-n 1.1-n n 3n
此时氢气的体积分数为3n/(2+2n),当CH4和H2O(g)的物质的量之比的比值为11/9时,起始时,甲烷的物质的量为1.1 mol,H2O(g)的物质的量为0.9 mol,反应达到平衡时,设CH4转化了y mol,则有:
CH4(g)+H2O(g) ![]() CO(g)+3H2(g)
CO(g)+3H2(g)
起始/(mol) 1.1 0.9 0 0
转化/(mol) y y y 3y
衡/(mol) 1.1-y 0.9-y y 3y
此时氢气的体积分数为3y/(2+2y),由题图2可知,a点和b点的氢气的体积分数相等,故n=y,a点甲烷的浓度等于b点水蒸气的浓度;两点的氢气产率相等;
故答案是:>; =;=。

【题目】已知某化学反应的平衡常数表达式为![]() ,在不同的温度下该反应的平衡常数值分别为:
,在不同的温度下该反应的平衡常数值分别为:
| 700 | 800 | 830 |
|
|
K |
|
|
|
|
|
下列有关叙述不正确的是![]()
![]()
A.该反应的化学方程式是![]()
B.上述反应的正反应是放热反应
C.如果在一定体积的密闭容器中加入![]() 和
和![]() 各
各![]() ,
,![]() 内温度升高到
内温度升高到![]() ,测得此时
,测得此时![]() 为
为![]() 时,推知此时反应为平衡状态
时,推知此时反应为平衡状态
D.如果平衡浓度符合关系式![]() ,判断此时的温度是
,判断此时的温度是![]()