题目内容
18.13克锌和足量的盐酸反应(1)在标准状况下,能生成多少升氢气?
(2)若所用盐酸浓度为1mol/L,需要这种盐酸多少毫升恰好完全反应?
分析 n(Zn)=$\frac{13g}{65g/mol}$=0.2mol,
(1)根据转移电子守恒计算生成氢气物质的量,再根据V=nVm计算氢气体积;
(2)根据转移电子守恒消耗盐酸物质的量,消耗盐酸体积=$\frac{n}{C}$.
解答 解:n(Zn)=$\frac{13g}{65g/mol}$=0.2mol,
(1)根据转移电子守恒得生成n(H2)=$\frac{0.2mol×2}{2}$=0.2mol,V(H2)=nVm=0.2mol×22.4L/mol=4.48L,
答:生成氢气体积为4.48L;
(2)根据转移电子守恒消耗盐酸物质的量=$\frac{0.2mol×2}{1}$=0.4mol,消耗盐酸体积=$\frac{n}{C}$=$\frac{0.4mol}{1mol/L}$=400mL,
答:需要这种盐酸400mL恰好完全反应.
点评 本题考查化学反应方程式有关计算,为高频考点,侧重考查学生分析计算能力,注意转移电子守恒的灵活运用,题目难度不大.

练习册系列答案
相关题目
8.将2molSO2和1molO2分别置于相同体积的甲乙两容器中发生反应2SO2+O2(g)?2SO3(g),并达到平衡.在这过程中,甲容器保持体积不变,乙容器保持压强不变.若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率( )
| A. | 等于p% | B. | 大于p% | C. | 小于p% | D. | 无法判断 |
9.下列叙述正确的是( )
| A. | 1 mol H2O的质量为18g/mol | |
| B. | 标准状况下,1 mol任何物质体积均为22.4L | |
| C. | CH4的摩尔质量为16g | |
| D. | 6.02×1023个O2分子的质量为32g |
13.将20gNaOH固体溶于水配成50mL溶液,其物质的量浓度为( )
| A. | 1mol/L | B. | 5mol/L | C. | 10mol/L | D. | 20mol/L |
3.短周期非金属元素甲~戊在元素周期表中的相对位置如表所示,下面判断不一定正确的是( )
| 甲 | 乙 | ||
| 丙 | 丁 | 戊 |
| A. | 原子半径:丙>丁>戊 | |
| B. | 最高化合价:甲<丁<戊 | |
| C. | 最高价氧化物的水化物的酸性:丙<甲<乙 | |
| D. | 非金属性:乙>丁>丙 |
10.向NaCl、NaBr、NaI的混合溶液中通入Cl2后,若溶液中含有Br2,则一定不含有( )
| A. | Cl2 | B. | I- | C. | Br- | D. | Cl- |
4.如表是周期表中短周期的一部分,A、B、C三种元素的原子核外电子数之和等于B的质量数的2.5倍,B元素的原子核内质子数等于中子数.
(1)写出A、B、C三种元素符号:P、O、Cl
(2)B元素位于周期表中第二周期第ⅥA族
(3)C的气态氢化物水溶液显酸性(填“酸”或“碱”)
| B | ||
| A | C |
(2)B元素位于周期表中第二周期第ⅥA族
(3)C的气态氢化物水溶液显酸性(填“酸”或“碱”)
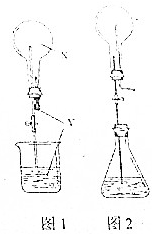 关于喷泉实验,回答下列问题:
关于喷泉实验,回答下列问题: