题目内容
6.T℃时,恒容密闭容器中反应2NO2 (g)═N2O4 (g)△H<0.达到化学平衡状态,请回答:(1)该反应的化学平衡常数的表达式K=$\frac{c({N}_{2}{O}_{4})}{{c}^{2}(N{O}_{2})}$.
(2)如果再通入一定量的二氧化氮,化学平衡向右移动(向左、向右、不),平衡常数不变(减小、增大、不变);达到新平衡时NO2的转化率增大(减小、增大、不变),NO2的体积百分含量减小(减小、增大、不变).
(3)如果升高温度,平衡混合物的颜色变深 (变深、变浅).
(4)下列描述中能说明该反应达到化学平衡状态的是BD(填字母)
A.单位时间内生成n mo1N2O4的同时生成n molNO2
B.混合气体的颜色不随时间而变化
C.混合气体的密度不随时间而变化
D.混合气体的平均相对分子质量不随时间而变化
E.容器内NO2和N2O4的浓度之比为2:1.
分析 (1)化学平衡常数是指:一定温度下,可逆反应到达平衡时,生成物的浓度系数次幂之积与反应物的浓度系数次幂之积的比,固体、纯液体不需要在化学平衡常数中写出;
(2)增大反应物浓度,平衡正向移动,平衡常数只受温度影响,温度不变,平衡常数不变,等效为在原平衡的基础上增大压强,与原平衡相比平衡正向移动,转化率增大,四氧化二氮体积分数增大,则NO2的体积百分含量减小;
(3)正反应为放热反应,如果升高温度,平衡逆向移动,二氧化氮的浓度增大;
(4)可逆反应到达平衡时,同种物质的正逆速率相等,各组分的浓度、含量保持不变,由此衍生的其它一些量不变,判断平衡的物理量应随反应进行发生变化,该物理量由变化到不变化说明到达平衡.
解答 解:(1)2NO2 (g)═N2O4 (g)的平衡常数表达式K=$\frac{c({N}_{2}{O}_{4})}{{c}^{2}(N{O}_{2})}$,故答案为:$\frac{c({N}_{2}{O}_{4})}{{c}^{2}(N{O}_{2})}$;
(2)如果再通入一定量的二氧化氮,平衡正向移动,平衡常数只受温度影响,浓度不影响平衡常数,温度不变,平衡常数不变;等效为在原平衡的基础上增大压强,与原平衡相比平衡正向移动,转化率增大,四氧化二氮体积分数增大,则NO2的体积百分含量减小,
故答案为:向右;不变;增大;减小;
(3)正反应为放热反应,如果升高温度,平衡逆向移动,二氧化氮的浓度增大,平衡混合物的颜色变深,故答案为:变深;
(4)A.单位时间内生成n mo1N2O4的同时生成2n molNO2时,处于平衡状态,故A错误;
B.混合气体的颜色不随时间而变化,说明二氧化氮的浓度不变,反应到达平衡,故B正确;
C.混合气体质量不变,容器容积不变,混合气体的密度始终不变,故C错误;
D.混合气体的质量不变,随反应进行混合气体物质的量减小,平均相对分子质量中等,当平均相对分子质量不随时间而变化,说明反应到达平衡,故D正确;
E.容器内NO2和N2O4的浓度之比与二氧化氮的转化率有关,不一定等于化学计量数之比,故E错误,
故选:BD.
点评 本题考查化学平衡影响因素、平衡状态判断、平衡常数等,注意判断平衡的物理量应随反应进行发生变化,该物理量由变化到不变化说明到达平衡.

| A. | HC≡CH+HCl$\stackrel{催化剂}{→}$H2C=CHCl | |
| B. | C 2H5OH+CH3COOH$→_{△}^{浓硫酸}$CH3COOC2H5+H2O | |
| C. | CH4+2O2 $\stackrel{点燃}{→}$ CO2+2H2O | |
| D. | 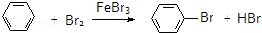 |
| A. | 它是氢的一种新同位素 | |
| B. | 这种新元素的核电荷数是3 | |
| C. | 它是H2的一种新同素异形体 | |
| D. | 它比一个普通氢分子多-个氢原子核 |
| A. | 由H2(g)、I2(g)、HI(g)组成的平衡体系加压后颜色变深 | |
| B. | 红棕色的NO2,加压后颜色先变深后变浅 | |
| C. | 实验室用排饱和食盐水法收集氯气 | |
| D. | 工业上利用O2与SO2反应制取SO3时通入过量O2 |
| A. | 44.8L | B. | 40L | C. | 22.4L | D. | 30L |
| A. | 80g | B. | 160g | C. | 98g | D. | 无法确定 |
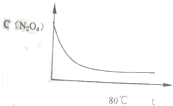 在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:时间(s) C(mol/L) | 0 | 20 | 40 | 60 | 80 | 100 |
| C(N2O4) | 0.20 | a | 0.10 | c | d | e |
| C(NO2) | 0.00 | 0.12 | b | 0.22 | 0.22 | 0.22 |
(1)该反应的化学方程式为N2O4?2NO2,表中b>c(填“<”、“=”、“>”).
(2)20s时,N2O4的浓度为0.14mol/L,0~20s内N2O4的平均反应速率为0.003mol/(L•s).
(3)该反应的平衡常数表达式K=$\frac{{c}^{2}(N{O}_{2})}{c({N}_{2}{O}_{4})}$,在80℃时该反应的平衡常数K值为0.54(保留2位小数).
(4)在其他条件相同时,该反应的K值越大,表明建立平衡时ABD.
A.N2O4的转化率越高 B.NO2的产量越大 C.N2O4与NO2的浓度之比越大 D.正反应进行的程度越大
(5)要增大该反应的K值,可采取的措施D
A.增大N2O4起始浓度 B.向混合气中通入NO2 C.使用高效催化剂 D.升高温度
(6)如图是80℃时容器中N2O4浓度随时间t的变化图,请在该图中补画出该反应在60℃反应时N2O4浓度的变化曲线.
 )等被广泛应用于石油化工、橡胶、塑料、制药等行业,用途十分广泛.二甘醇(物质D)一般的合成路线为:
)等被广泛应用于石油化工、橡胶、塑料、制药等行业,用途十分广泛.二甘醇(物质D)一般的合成路线为: