题目内容
8.将2molSO2和1molO2分别置于相同体积的甲乙两容器中发生反应2SO2+O2(g)?2SO3(g),并达到平衡.在这过程中,甲容器保持体积不变,乙容器保持压强不变.若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率( )| A. | 等于p% | B. | 大于p% | C. | 小于p% | D. | 无法判断 |
分析 在相同温度下发生反应2SO2+O2?2SO3,该反应为气体物质的量减小的反应,若甲容器保持体积不变,乙容器保持压强不变,则随着反应的进行,甲的压强逐渐减小,达平衡时,乙容器压强大于甲容器压强,根据压强对平衡移动的影响分析.
解答 解:2SO2+O2?2SO3反应为气体物质的量减小的反应,
若甲容器保持体积不变,乙容器保持压强不变,则随着反应的进行,甲的压强逐渐减小,
乙容器压强大于甲容器压强,
增大压强,平衡向正反应方向移动,
当甲中的SO2的转化率为p%时,则乙容器中SO2的转化率应是大于p%,
故选B.
点评 本题考查化学平衡的影响因素,题目难度中等,注意根据反应方程式的特点把握压强对平衡移动的影响.

练习册系列答案
相关题目
13.具有相同的电子层结构的四种微粒:aAn+、bB(n+1)+、cCn-、dD(n+1)-,关于A、B、C、D四种元素叙述正确的是( )
| A. | 一定都是短周期元素 | B. | 原子序数:B>A>C>D | ||
| C. | 单质的还原性:B>A | D. | 气态氢化物的稳定性:D>C |
20.锌与100mL 18.5mol•L-1的浓硫酸充分反应后,锌完全溶解,同时生成气体甲33.6L(标准状况).将反应后的溶液稀释至1L,测得溶液的pH=1.下列叙述正确的是.( )
| A. | 反应中共消耗1.85 mol H2SO4 | B. | 气体甲中SO2与H2的体积比为1:4 | ||
| C. | 反应中共消耗65 g Zn | D. | 反应中共转移3.6 mol电子 |
17.下列有机反应属于加成反应的是( )
| A. | HC≡CH+HCl$\stackrel{催化剂}{→}$H2C=CHCl | |
| B. | C 2H5OH+CH3COOH$→_{△}^{浓硫酸}$CH3COOC2H5+H2O | |
| C. | CH4+2O2 $\stackrel{点燃}{→}$ CO2+2H2O | |
| D. | 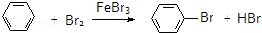 |
 )等被广泛应用于石油化工、橡胶、塑料、制药等行业,用途十分广泛.二甘醇(物质D)一般的合成路线为:
)等被广泛应用于石油化工、橡胶、塑料、制药等行业,用途十分广泛.二甘醇(物质D)一般的合成路线为: