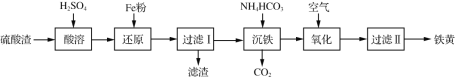
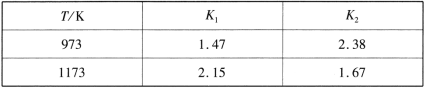
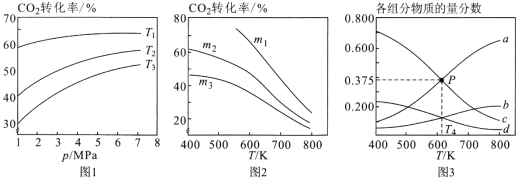
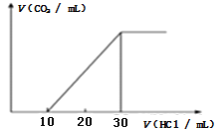
题目内容
【题目】25℃,四种水溶液① HCl ,② FeCl3 ,③ KOH ,④ Na2CO3 四种水溶液的PH依次为 4、4 、10 、10 ,各溶液中水的电离程度大小关系正确的是 ( )
A.①=②=③=④B.①>③>②>④C.④=②>③=①D.①=③>②=④
【答案】C
【解析】
酸或碱抑制水电离,酸中氢离子或碱中氢氧根离子浓度越大其抑制水电离程度越大;含有弱离子的盐促进水电离,弱离子水解程度越大,水的电离程度越大。
①是酸、③是碱,所以二者抑制水电离,①PH=4的HCl溶液中水电离出的氢离子浓度是![]() ;③PH=10的KOH溶液中水电离出的氢离子浓度是
;③PH=10的KOH溶液中水电离出的氢离子浓度是![]() ;所以二者抑制水电离程度相同;②、④都是含有弱离子的盐,促进水电离,②PH=4的FeCl3溶液中水电离出的氢离子浓度是
;所以二者抑制水电离程度相同;②、④都是含有弱离子的盐,促进水电离,②PH=4的FeCl3溶液中水电离出的氢离子浓度是![]() ,④PH=10的Na2CO3溶液中水电离出的氢离子浓度是
,④PH=10的Na2CO3溶液中水电离出的氢离子浓度是![]() ,②、④水电离程度相同,则水的电离程度大小顺序是④=②>③=①,故选C。
,②、④水电离程度相同,则水的电离程度大小顺序是④=②>③=①,故选C。

练习册系列答案
相关题目
【题目】下列各物质中,不能够按照![]() (“→”表示一步完成)关系相互转化的是( )
(“→”表示一步完成)关系相互转化的是( )
物质 选项 | a | b | c |
A | Na | Na2O2 | NaCl |
B | AlCl3 | Al(OH)3 | NaAlO2 |
C | FeO | Fe(NO3)2 | Fe(OH)2 |
D | CuO | CuSO4 | Cu(OH)2 |
A. AB. BC. CD. D