题目内容
【题目】碳及其化合物广泛存在于自然界。请回答下列问题:
(1)反应Ⅰ:Fe(s)+CO2(g) ![]() FeO(s)+CO(g) ΔH1 平衡常数为K1
FeO(s)+CO(g) ΔH1 平衡常数为K1
反应Ⅱ:Fe(s)+H2O(g) ![]() FeO(s)+H2(g) ΔH2 平衡常数为K2
FeO(s)+H2(g) ΔH2 平衡常数为K2
不同温度下,K1、K2的值如下表:
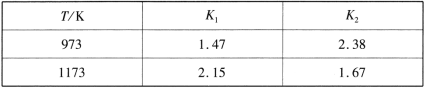
现有反应Ⅲ:H2(g)+CO2(g) ![]() CO(g)+H2O(g),结合上表数据,反应Ⅲ是_______ (填“放热”或“吸热”)反应。
CO(g)+H2O(g),结合上表数据,反应Ⅲ是_______ (填“放热”或“吸热”)反应。
(2)已知CO2催化加氢合成乙醇的反应原理为:
2CO2(g)+6H2(g) ![]() C2H5OH(g)+3H2O(g) H<0。
C2H5OH(g)+3H2O(g) H<0。
设m为起始时的投料比,即m= n(H2)/ n(CO2)。
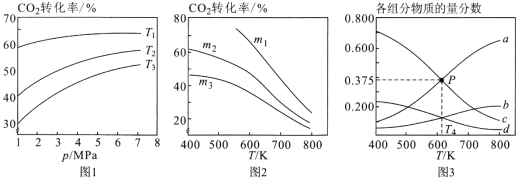
①图1中投料比相同,温度从高到低的顺序为______________________。
②图2中m1、m2、m3从大到小的顺序为________________________。
③图3表示在总压为5MPa的恒压条件下,且m=3时,平衡状态时各物质的物质的量分数与温度的关系。则曲线d代表的物质化学名称为______________,T4温度时,该反应平衡常数KP的计算式为(不必化简)_______________________。
(3)已知:NH3·H2O的Kb=1.7×10-5,H2CO3的Ka1=4.3×10-7、Ka2=5.6×10-11。工业生产尾气中的CO2捕获技术之一是氨水溶液吸收技术,工艺流程是将烟气冷却至15.5℃~26.5℃后用氨水吸收过量的CO2。所得溶液的pH___________7(填“>”、“=”或“<”)。烟气需冷却至15.5℃~26.5℃的可能原因是____________。
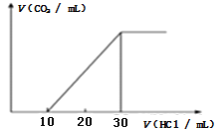
(4)为了测量某湖水中无机碳含量,量取100mL湖水,酸化后用N2吹出CO2,再用NaOH溶液吸收。往吸收液中滴加1.0mol/L盐酸,生成的V(CO2)随V(盐酸)变化关系如图所示,则原吸收液中离子浓度由大到小的顺序为__________。
【答案】吸热 ![]()
![]() 乙醇
乙醇 ![]() > 降低吸收过程中氨水的挥发,促进氨水对CO2的吸收 c(Na+)> c(HCO3-) > c(CO32-) > c(OH-) > c(H+)
> 降低吸收过程中氨水的挥发,促进氨水对CO2的吸收 c(Na+)> c(HCO3-) > c(CO32-) > c(OH-) > c(H+)
【解析】
(1)由图可知反应①的K1随温度升高而增大,说明正反应为吸热反应,△H>0,反应②的K2随温度升高而减小,说明正反应为放热反应,△H<0,已知:①Fe(s)+CO2(g)![]() FeO(s)+CO(g)△H1=Q1>0,②Fe(s)+H2O(g)
FeO(s)+CO(g)△H1=Q1>0,②Fe(s)+H2O(g)![]() FeO(s)+H2(g)△H2=Q2<0,由盖斯定律①-②得③H2(g)+CO2(g)
FeO(s)+H2(g)△H2=Q2<0,由盖斯定律①-②得③H2(g)+CO2(g)![]() CO(g)+H2O(g))△H=Q3=Q1-Q2>0,说明是吸热反应;
CO(g)+H2O(g))△H=Q3=Q1-Q2>0,说明是吸热反应;
(2)①反应为放热反应,温度越高转化率越小,则T3>T2>T1;
②图2中m1、m2、m3投料比从大到小的顺序为m1>m2>m3,因相同温度下,增大氢气的量,平衡正向移动,二氧化碳的转化率增大;
③温度升高,反应逆向进行,所以产物的物质的量是逐渐减少的,反应物的物质的量增大,由图可知,曲线a代表的物质为H2,b表示CO2,c为H2O,d表示乙醇;设开始氢气的投入量是3nmol,则二氧化碳是nmol,二氧化碳的转化量是x,则
2CO2(g)+6H2(g)![]() C2H5OH(g)+3H2O(g)
C2H5OH(g)+3H2O(g)
起始量(mol) n 3n 0 0
变化量(mol) x 3x 0.5x 1.5x
平衡量(mol) n-x 3n-3x 0.5x 1.5x
P点a、c的体积分数相同,所以3n-3x=1.5x,解得x=![]() n,总物质的量是n-x+3n-3x+0.5x+1.5x=
n,总物质的量是n-x+3n-3x+0.5x+1.5x=![]() n,总压为5MPa的恒压条件下,p(二氧化碳)=p(乙醇)=
n,总压为5MPa的恒压条件下,p(二氧化碳)=p(乙醇)=![]() ×5MPa=0.125×5MPa,p(氢气)=p(水)=
×5MPa=0.125×5MPa,p(氢气)=p(水)=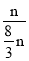 ×5MPa=0.375×5MPa,T4温度时,该反应的平衡常数Kp=
×5MPa=0.375×5MPa,T4温度时,该反应的平衡常数Kp=![]() ;
;
(3)工艺流程是将烟气冷却至15.5~26.5℃后用氨水吸收过量的CO2,该反应是一水合氨和二氧化碳反应生成碳酸氢铵,反应的化学方程式为:NH3H2O+CO2=NH4HCO3,由NH3·H2O的Kb=1.7×10-5,H2CO3的Ka1=4.3×10-7、Ka2=5.6×10-11可知HCO3-的水解程度大于NH4+的水解程度,则所得溶液的pH>7;烟气需冷却至15.5~26.5℃的可能原因是:降低吸收过程中氨气挥发,促进氨水对二氧化碳的成分吸收;
(4)为了测量某湖水中无机碳含量,量取100mL湖水,酸化后用N2吹出CO2,再用NaOH溶液吸收,图象分析可知,生成碳酸氢钠溶液和碳酸钠溶液,二者物质的量之比为1:1,且CO32-的水解程度大于HCO3-,则溶液中离子浓度大小为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)。