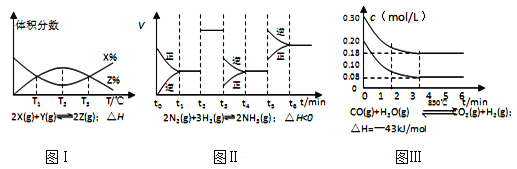
题目内容
【题目】下列实验设计及其对应的离子方程式均正确的是( )
A.用FeCl3溶液腐蚀铜线路板:Cu + 2Fe3+=Cu2+ + 2Fe2+
B.Na2O2与H2O反应制备O2 :2O22-+2H2O=4OH-+O2↑
C.铁钉放入硫酸铜溶液中:2Fe+3Cu2+=2Fe3++3Cu
D.用食醋除去水瓶中的水垢:![]()
【答案】A
【解析】
A.用FeCl3溶液腐蚀铜线路板,离子方程式:Cu+2Fe3+=Cu2++2Fe2+,故A正确;
B.Na2O2与H2O反应制备O2,离子方程式:2Na2O2+2H2O=4Na++4OH-+O2↑,故B错误;
C.Fe与硫酸铜发生置换反应,生成硫酸亚铁和Cu,离子反应为Fe+Cu2+═Fe2++Cu,故C错误;
D.用食醋除去水瓶中的水垢的离子反应为CaCO3+2CH3COOH═CO2↑+H2O+2CH3COO-,故D错误;
故选A。

【题目】纯过氧化氢是淡蓝色的黏稠液体,可与水以任意比混合,其水溶液俗称双氧水,为无色透明液体。实验室常用过氧化氢制取氧气,工业上过氧化氢是重要的氧化剂和还原剂,常用于消毒、杀菌、漂白等。某化学兴趣小组的同学围绕过氧化氢开展了调查研究与实验,请你参与其中一起完成下列学习任务:
(1)写出过氧化氢的电子式:_____。
(2)实验室中用过氧化氢制取氧气的化学方程式为____,当生成标准状况下1.12 L O2时,转移电子为___ mol。
(3)该兴趣小组的同学查阅资料后发现H2O2为二元弱酸,其酸性比碳酸弱。请写出H2O2在水溶液中的电离方程式:___________。
(4)同学们用0.1000 mol·L-1的酸性高锰酸钾标准溶液滴定某试样中过氧化氢的含量。
①写出该反应的离子方程式____________。
②滴定到达终点的现象是____________。
③用移液管吸取25.00 mL试样置于锥形瓶中,重复滴定四次,每次消耗的酸性KMnO4标准溶液体积如下表所示:
第一次 | 第二次 | 第三次 | 第四次 | |
体积(mL) | 17.10 | 19.10 | 17.00 | 16.90 |
则试样中过氧化氢的浓度为____mol·L-1。
④若滴定前尖嘴中有气泡,滴定后消失,则测定结果____(填“偏低”、“偏高”或“不变”)。
(5)同学们发现向滴加了酚酞的NaOH溶液中加入H2O2后,溶液中红色消失。关于褪色原因:甲同学认为H2O2是二元弱酸,消耗了OH-使红色消失;乙同学认为H2O2具有漂白性使溶液褪色。请设计一个简单的实验方案来判断甲、乙两位同学的说法是否正确___________。
【题目】铁是人体必须的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:
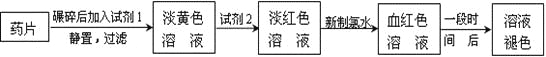
(1)试剂1是_______________________。
(2)加入KSCN溶液后,在未加新制氯水的情况下,溶液中也产生了红色,其可能的原因是_______________________________________________________________。
(3)在实验中发现放置一段时间,溶液的颜色会逐渐褪去。为了进一步探究溶液褪色的原因,甲、乙、丙三位同学首先进行了猜想:
编号 | 猜想 |
甲 | 溶液中的+3价Fe又被还原为+2价Fe |
乙 | 溶液中的SCN-被过量的氯水氧化 |
丙 | 新制的氯水具有漂白性,将该溶液漂白 |
基于乙同学的猜想,请设计实验方案,验证乙同学的猜想是否正确。写出有关的实验操作、预期现象和结论。(不一定填满,也可以补充)
编号 | 实验操作 | 预期现象和结论 |