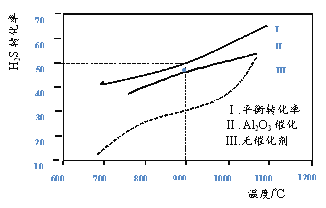
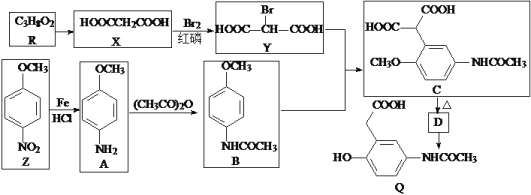
��Ŀ����
����Ŀ������������(C4H2O4Fe)�dz��õ�����ƶѪ��ҩ����ɸ�������FeSO4��Ӧ�Ʊ���
(1)�Ʊ�FeSO4��Һ��ʵ�鲽�����£�
����1.��ȡ4.0g����м�������ձ��У�����10%Na2CO3��Һ����С�ˮϴ�����ԡ�
����2.����ϴ�������м�м���3mol/L H2SO4��Һ20mL�����ϱ�������ˮԡ�м��ȡ���ʱ���ձ��еμ���������ˮ��������Һ��pH������1��
����3.����Ӧ�ٶ����Լ������ȹ��˵�FeSO4��Һ��
�ٲ���1��ʵ��Ŀ����____��
�ڲ���2����ʱ���ձ��еμ���������ˮ����Ŀ����____����������Һ��pH������1����Ŀ����____��
(2)��ȡ������������ʵ�鲽�輰���裨��ʵ��װ�����£�
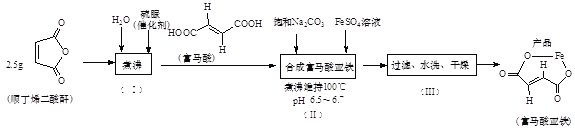
�ٲ���(��)���ò�Ʒ(������)Ϊ_______����ϩ���ᣨ����˳��������������
�ڸ�����������Na2CO3��Һ��Ӧ�ķ���ʽΪ_________��
��ͼ������X��������_________��ʹ�ø�������Ŀ����__________��

(3)�ⶨ(2)��Ʒ���������������IJ���Ϊ��ȷ��ȡ��Ʒag�� ��������й���3mol/LH2SO4��Һ15mL������Ʒ��ȫ�ܽ���ټ�������й�����ˮ50mL��4���ڶ�����-����ָʾ����������cmol/L (NH4)2Ce(SO4)3����Һ�ζ�(Ce4++Fe2+=Ce3++Fe3+)���ζ����յ�ʱ���ı�ҺVmL��
��(NH4)2Ce(SO4)3����Һ����ʢ����_______(������ʽ��������ʽ��)�ζ����С�
�ڸ�ʵ�����ܷ���KMnO4����Һ����(NH4)2Ce(SO4)3����Һ�ζ�Fe2+��˵������_____��
�۲�Ʒ��������������Ϊ________���ú�a��V�Ĵ���ʽ��ʾ����
���𰸡���ȥ����������� ������������ˮ�ݣ���ֹ���������������� ����Fe2+ˮ�� �� 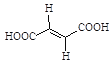 +Na2CO3
+Na2CO3![]()
 +CO2��+H2O (���Σ�����)������ ��������ˮ ��ʽ ���ܣ�KMnO4��Һ������Fe2+�⣬���������������е�̼̼˫��
+CO2��+H2O (���Σ�����)������ ��������ˮ ��ʽ ���ܣ�KMnO4��Һ������Fe2+�⣬���������������е�̼̼˫�� ![]()
��������
(1)�ٲ���1�м���̼������Һ�Լ��ԣ���ȥ�����ۣ�
�ڸ��ݸò���������ˮ������������ҺŨ�ȱ����������ε�ˮ��Ƕȷ�������pH��С��ԭ��
(2)�ٸ���������ͬ������˫��ͬһ���Ϊ˳ʽ�ṹ���ڲ�ͬ���Ϊ��ʽ�ṹ������
�ڸ�����������Ա�̼������ǿ��ǿ����������η�Ӧ����ǿ���κ�������д��
�۸��������Ľṹ���������ʵ������ж������ã�
(3)�ٸ�������Һ��������ж�ʹ�õζ��ܵ����ࣻ
��KMnO4��Һ����ǿ�����ԣ���������Fe2+��̼̼˫����
�۸������ı���Һ�������Ũ�ȼ���n(Fe2+)���ټ��������������������ʵĺ������㹫ʽ������������������
(1)�ٲ���1�м���̼������ǿ�������Σ�����ҺCO32-ˮ�⣬����ˮ���������H+��ʹ��Һ�Լ��ԣ���֬�ܹ�������Ӧ���������Ե����ʣ���˼���̼������ҺĿ����ȥ����ȥ������������ۣ�
�ڲ���2����ʱ���ձ��еμ���������ˮ����Ŀ���Dz�����������ˮ�ݣ���ֹ������������������FeSO4��ǿ�������Σ�Fe2+ˮ��ʹ��Һ�����ԣ���������Һ��pH������1���Ϳ�������Fe2+ˮ�⣬��ֹ�γ�Fe(OH)2������
(2)�ٲ���(��)���ò�Ʒ(������)�ṹ��ʽΪ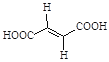 ����֪��������ͬ��ԭ�ӻ�ԭ������̼̼˫�������࣬��˸ø������Ƿ�ʽ�ṹ������Ϊ������ϩ���
����֪��������ͬ��ԭ�ӻ�ԭ������̼̼˫�������࣬��˸ø������Ƿ�ʽ�ṹ������Ϊ������ϩ���
�ڸ�����������Na2CO3��Һ��Ӧ�����������ơ�ˮ��������̼����Ӧ�Ļ�ѧ����ʽΪ�� +Na2CO3
+Na2CO3![]()
 +CO2��+H2O��
+CO2��+H2O��
���������Ľṹ��֪�����������������������ܣ�����������������ˮ������ˮ�ֻӷ���
(3)��(NH4)2Ce(SO4)3��ǿ�������Σ�ˮ��ʹ��Һ�����ԣ�����Ӧ�ý������Һ����ʢ������ʽ�ζ����У�
��ʹ��(NH4)2Ce(SO4)3����Һ�ζ���ֻ����Ce4++Fe2+=Ce3++Fe3+����ʹ��KMnO4����Һ������KMnO4����ǿ�����ԣ�������������Fe2+��Ҳ��������̼̼˫�������Բ��������ⶨFe2+��
�۸���Ce4++Fe2+=Ce3++Fe3+��֪n(Fe2+)=cmol/L��V��10-3L=cV��10-3mol����m(Fe2+)=56cV��10-3g�����Բ�Ʒ��������������Ϊ![]() ��100%��
��100%��

����Ŀ��������̼��Դ��������Ŀǰ�о����ȵ�֮һ��
(1)������̼������������Ȼ���ƺϳ���(CO��H2)��
����֪�����Ȼ�ѧ����ʽ��CH4(g)+H2O(g)![]() CO(g)+3H2(g) ��H1=+206kJ/mol��CO2(g)+4H2(g)
CO(g)+3H2(g) ��H1=+206kJ/mol��CO2(g)+4H2(g) ![]() CH4(g)+2H2O(g) ��H 2=-165kJ/mol��
CH4(g)+2H2O(g) ��H 2=-165kJ/mol��
��ӦCH4(g)+CO2(g)![]() 2CO(g)+2H2(g)����H=____kJ/mol��
2CO(g)+2H2(g)����H=____kJ/mol��
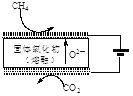
������ҹ�ѧ�߲��õ��������CO2����CH4��ȡ�ϳ�����װ����ͼ��ʾ��װ�ù���ʱ�������ĵ缫��ӦʽΪ________��
(2)�ɶ�����̼�ϳ�VCB��﮵�ص���ʵ����Ӽ�����ʵ���������£���֪EC��VCB�˴Ź�������ֻ��һ��壬������Ԫ��״�ṹ��EC��ˮ�������Ҷ�����
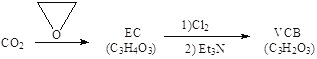
VCB�Ľṹ��ʽΪ_________��
(3)����ֱ���Ƚ������CO2���������������ػ�ѧ����ʽ��ƽ��ת�������¶ȵĹ�ϵ���£�
(I)����ֱ���Ƚ����⣺C2H6(g)![]() C2H4(g)+H2(g) ��H1
C2H4(g)+H2(g) ��H1
(��)CO2�����������⣺C2H6(g)+CO2(g)![]() C2H4(g)+CO(g)+H2O(g) ��H2
C2H4(g)+CO(g)+H2O(g) ��H2
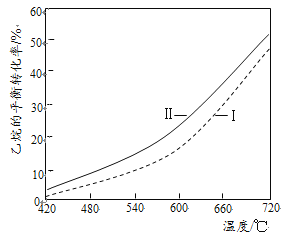
�ٷ�Ӧ(I)����H1= ____kJ/mol������ֵ����ؼ����������±�����
��ѧ�� | C��C | C=C | C��H | H��H |
����/kJ��mol��1 | 347.7 | 615 | 413.4 | 436.0 |
�ڷ�Ӧ(��)����ƽ��ת���ʱȷ�Ӧ(I)�Ĵ���ԭ����______����ƽ���ƶ��Ƕ�˵������
����ѧ���о�����Cr2O3��CO2�����������⣬ͨ��XPS�ⶨ�������������Cr6+��Cr3+���Ӷ�˵������Ӧ����Ϊ��C2H6(g)��C2H4(g)+H2(g)��______��_______���÷���ʽ��ʾ������ע����Ӧ��������
���������ݻ���ͬ�ĺ����ܱ������У��¶ȼ���ʼʱͶ�����±���ʾ������������ֻ������Ӧ��C2H6(g)img src="http://thumb.1010pic.com/questionBank/Upload/2019/10/07/08/dcc46cb6/SYS201910070801057716573811_ST/SYS201910070801057716573811_ST.001.png" width="33" height="10" style="-aw-left-pos:0pt; -aw-rel-hpos:column; -aw-rel-vpos:paragraph; -aw-top-pos:0pt; -aw-wrap-type:inline" />C2H4(g)+H2(g)���¶ȼ�Ͷ�Ϸ�ʽ�����±���ʾ������÷�Ӧ������������£�
����1 | ����2 | ����3 | |
��Ӧ�¶�T/K | 600 | 600 | 500 |
��Ӧ��Ͷ���� | 1molC2H6 | 2molC2H4+2molH2 | 1molC2H6 |
ƽ��ʱv��(C2H4)/ mol/(L��s) | v1 | v2 | v3 |
ƽ��ʱc(C2H4)/ mol/L | c1 | c2 | c3 |
ƽ�ⳣ��K | K1 | K2 | K3 |
����˵����ȷ����_______�����ţ���
A.K1=K2��v1<v2 B.K1<K3��v1< v3 C.v2>v3��c2>2c3 D.c2+c3<3c1
����Ŀ�����и���ʵ��������������ó��Ľ�����ȷ����
ѡ�� | ʵ����� | ʵ������ | ���� |
A | ��SO2����ͨ��Ba(NO3)2��Һ | �а�ɫ���� | SO2�л���SO3 |
B | ��NaAlO2��Һ�г���ͨ������Y | �ȳ��ְ�ɫ���������ճ������ܽ� | Y������CO2���� |
C | AgCl����Һ�е�������Na2S��Һ | �������ɫ | Ksp(Ag2S)>Ksp(AgCl) |
D | ��ʢ��KI3��Һ�����Թ��зֱ���������Һ��AgNO3��Һ | ǰ����Һ����ɫ�������л�ɫ���� | KI3��Һ�д���ƽ��: I3�� |
A. A B. B C. C D. D