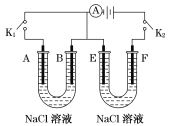
题目内容
【题目】现有下列物质:①Cl2 ②SO2 ③0.1mol·L-1Na2CO3溶液中的溶质 ④0.1mol·L-1的氨水中的NH3·H2O ⑤0.1mol·L-1CH3COOH溶液中的溶质 ⑥BaSO4。
(1)属于强电解质的是_____,属于弱电解质的是_____,属于非电解质的是_______,向⑤中加入等物质的量④,溶液导电性____(填“增强”或“减弱”)。
(2)已知③溶液呈碱性,甲同学认为显碱性原因是CO32-水解所致,为证明上述观点是否正确,请设计一个简单的实验,简述实验过程。___________。
(3)在T℃时,反应2SO2(g)+O2(g)![]() 2SO3(g) △H<0的平衡常数K=6×102,则:
2SO3(g) △H<0的平衡常数K=6×102,则:
①温度升高,化学平衡移动后,平衡常数K值________(填“增大”、“减少”或“不变”)。
②T℃时,向容积为2L的密闭容器中充入0.4molSO2、0.18molO2和1.2molSO3的混合气体,此时该反应是否处于化学平衡状态____(填“是”或“否”),化学反应速率v(正)___v(逆)(填“大于”、“等于”或“小于”)。
【答案】③⑥ ④⑤ ② 增强 向纯碱溶液中滴加数滴酚酞试液后,溶液显红色;然后逐滴加入氯化钙溶液直至过量,若溶液红色逐渐变浅直至消失,则说明上述观点 减小 否 大于
【解析】
(1)酸、碱、盐、金属氧化物和水为电解质,除有机酸外的有机物、非金属氧化物、大部分非金属氢化物等是非电解质,其中强酸、 强碱和绝大部分盐是强电解质。溶液的导电性强弱取决于溶液中离子的总浓度。
(2)设计实验时,既要证明溶液呈碱性,又要证明碱性与CO32-相关,即碱性随CO32-浓度的变化而变化。
(3)由温度变化后平衡移动的方向确定温度改变与平衡常数的影响;利用浓度商与平衡常数的比较,既可确定是否为平衡状态,又可确定平衡移动的方向,从而确定正、逆反应速率的大小关系。
(1) Na2CO3、BaSO4溶于水的部分发生完全电离,则为强电解质,所以属于强电解质的是③⑥;NH3·H2O、CH3COOH溶于水的部分中,只有一部分发生电离,则为弱电解质,所以属于弱电解质的是④⑤;SO2的水溶液能导电,但导电离子来自H2SO3,SO2为非电解质,所以属于非电解质的是②;向⑤中加入等物质的量④,发生反应生成CH3COONH4,溶液中离子浓度增大,所以溶液的导电性增强。答案为:③⑥;④⑤;②;增强;
(2)证明碳酸钠溶液显碱性是CO32-水解所致,需证明溶液的碱性随c(CO32-)的改变而改变,可用酚酞变红证明溶液呈碱性,用滴加CaCl2溶液的方法降低溶液中c(CO32-),从而引起溶液红色变化,因此设计的简单实验为:向纯碱溶液中滴加数滴酚酞试液后,溶液显红色;然后逐滴加入氯化钙溶液直至过量,若溶液红色逐渐变浅直至消失,则说明上述观点。答案为:向纯碱溶液中滴加数滴酚酞试液后,溶液显红色;然后逐滴加入氯化钙溶液直至过量,若溶液红色逐渐变浅直至消失,则说明上述观点;
(3)①正反应放热,温度升高,化学平衡逆向移动,则平衡常数K值减少。答案为:减小;
②T℃时,向容积为2L的密闭容器中充入0.4molSO2、0.18molO2和1.2molSO3的混合气体,此时浓度商Q=![]() =
=![]() =100<6×102,该反应没有处于化学平衡状态;平衡正向移动,所以化学反应速率v(正)大于v(逆)。答案为:否;大于。
=100<6×102,该反应没有处于化学平衡状态;平衡正向移动,所以化学反应速率v(正)大于v(逆)。答案为:否;大于。

【题目】在一定体积的密闭容器中进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
t/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=___;
(2)该反应为___(填“吸热”或“放热”)反应;
(3)能判断该反应达到化学平衡状态的依据是___;
A.容器中压强不变
B.混合气体中c(CO)不变
C.V正(H2)=V逆(H2O)
D.c(CO2)=c(CO)
(4)在800℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)为2mol·L-1,c(H2)为1.5mol·L-1,c(CO)为1mol·L-1,c(H2O)为3mol·L-1,则下一时刻,反应向___(填“正向”或“逆向”)进行。