题目内容
【题目】“速力菲”是一种人工合成的补铁剂,某研究性学习小组为探究其主要成分,进行了如下实验:
(Ⅰ)打开这种药片的密封膜,发现其外观为淡黄色;
(Ⅱ)将“速力菲”投入小试管中,加入少量蒸馏水,充分振荡后发现溶液变浑浊;慢慢加入稀硫酸后溶液变得澄清透明并显黄色;滴加KSCN溶液,立即变为血红色.学生甲由此断定“速力菲”的主要成分是三价铁盐;
(Ⅲ)学生乙的操作与甲大致相同,所不同的是他动作敏捷,且在振荡前用橡皮塞塞紧试管口.结果发现:溶液仅显示淡红色.乙同学认为“速力菲”的主要成分不是三价铁盐而是亚铁盐.
(Ⅳ)为了确认甲、乙的结论是否正确,学生丙将乙所得的淡红色溶液分成两份继续进行实验:
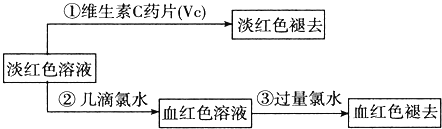
试回答下列问题:
(1)甲、乙两位同学的结论中比较合理的是 ______ ,另一同学判断出错的原因是 ______ .
(2)丙的实验①说明维生素C具有较强的 ______ 性![]() 填“氧化”或“还原”
填“氧化”或“还原”![]() .
.
(3)写出与丙的实验②中现象对应的离子反应方程式 ______;______ .
(4)关于丙的实验③中的现象,丙同学提出了两种假设:一种是过量的氯水与Fe3+结合生成了某种稳定的新物质;另一种则是过量的氯水将SCN-氧化了.请你设计一个实验方案以确认哪种假设更合理 ______ .
(5)针对实验目的,本次实验尚未完成的任务是 ______.
【答案】乙 甲同学操作慢,溶液中的Fe2+被氧气氧化成Fe3+ 还原 ![]()
![]() 在溶液中继续加入过量的FeCl3溶液,若呈现血红色,则是过量氯水与Fe3+结合,反之,则是过量氯水将SCN-氧化 未检测阴离子
在溶液中继续加入过量的FeCl3溶液,若呈现血红色,则是过量氯水与Fe3+结合,反之,则是过量氯水将SCN-氧化 未检测阴离子
【解析】
(Ⅰ)打开这种药片的密封膜,发现其外观为淡黄色;
(Ⅱ)将“速力菲”投入小试管中,加入少量蒸馏水,充分振荡后发现溶液变浑浊;慢慢加入稀硫酸后溶液变得澄清透明并显黄色;滴加KSCN溶液,立即变为血红色.可能是操作慢导致亚铁离子被空气中氧气氧化;
(Ⅲ)学生乙的操作与甲大致相同,所不同的是他动作敏捷,且在振荡前用橡皮塞塞紧试管口.结果发现:溶液仅显示淡红色,只有少部分被已化为铁离子,学生丙将乙所得的淡红色溶液分成两份继续进行实验,乙得到的淡红色溶液滴入几滴氯水呈血红色,加入过量氯水血红色褪去,说明原淡红色溶液中含亚铁离子,被氯气氧化为铁离子遇到KSCN变红色,加入过量氯水红色褪去过量的氯水与Fe3+结合生成了某种稳定的新物质;另一种则是过量的氯水将SCN-氧化了,淡红色溶液中加入维生素C淡红色褪去证明维生素C具有还原性能还原为亚铁离子,![]() 平衡逆向进行,淡红色褪去,
平衡逆向进行,淡红色褪去,
(1) 根据亚铁离子易被空气中氧气氧化的化学性质及甲、乙同学的操作是否严密进行分析;
(2)根据三价铁离子具有氧化性及淡黄色褪去判断维生素具有的性质;
(3)加入氯水,亚铁离子被氧化成了三价铁离子;硫氰化钾与铁离子生成硫氰化铁;
(4)可以向反应后的溶液中重新加入硫氰化钾溶液,根据现象判断两种假设的合理性;
(5)研究性学习小组为探究其主要成分,根据题中信息找出本次实验尚未完成的任务未能测出“速力菲”成分。
(1)由于亚铁离子容易被空气中的氧气氧化,乙同学动作敏捷,且在振荡前用橡皮塞塞紧试管口,而甲同学充分振荡后,慢慢加入稀硫酸,所以乙同学比较合理;
(2)由于三价铁离子具有氧化性,加入维生素后淡红色褪去,铁离子被维生素还原成了亚铁离子;
(3)②中现象对应的反应方是氯气和亚铁离子的反应及硫氰化钾与铁离子反应生成血红色的硫氰化铁,反应的离子方程式是:![]() ,
,![]() ;
;
(4)若是氯水将SCN-氧化了,可以重新加入硫氰化钾溶液,观察现象,如果变成血红色,第二种假设合理;如果不变色,说明第一种假设合理;
(5)根据“某研究性学习小组为探究其主要成分,进行了如下实验”,本次实验尚未完成的任务是:未能测出“速力菲”成分;

 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案