题目内容
【题目】钛酸钡粉体是电子陶瓷元器件的重要基础原料。工业上以TiCl4、BaCO3、H2C2O4等物质为原料制备草酸氧钛钡晶体[BaTiO(C2O4)2·4H2O],再高温煅烧制得钛酸钡粉体。请回答下列问题:
(1)基态Ti原子的价电子排布图为__,同周期元素中,基态原子未成对电子数与Ti相同的元素有___(填元素符号)。
(2)第IIA族(碱土金属)元素的原子序数、原子半径、第一电离势(从元素的气态基态原子中将一个电子移至无穷远处时所需做的功)如下表所示。
元素 | 原子序数 | 原子半径/pm | 每一电离势/eV |
Be | 4 | 89 | 9.32 |
Mg | 12 | 136 | 7.644 |
Ca | 20 | 174 | 6.111 |
Sr | 38 | 191 | 5.692 |
Ba | 56 | 198 | 5.21 |
①由上表数据可知,相邻元素原子半径差值r(Be-Mg)、r(Mg-Ca)明显大于r(Ca-Sr)、r(Sr-Ba),试解释其原因__。
②由上表数据可知,随原子序数的递增,第IIA族元素的第一电离势依次减小,试解释其原因__。
(3)已知草酸分子的结构简式为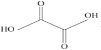 。
。
①草酸分子中,碳原子的杂化方式为__。
②由此结构简式可预测草酸__(填“难溶”“微溶”或“易溶”)于水和乙醇。
③已知草酸和液溴的相关数据如下,草酸熔点高于液溴的原因是__。
名称 | 化学式 | 相对子质量 | 熔点 |
草酸 | H2C2O4 | 90 | 101℃ |
液溴 | Br2 | 160 | -7.2℃ |
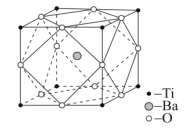
(4)设NA是阿伏加德罗常数的值,已知钛酸钡的立方晶胞结构如图所示,晶胞中Ti原子的配位数为__,其晶胞参数约为apm,钛酸钡晶体的密度ρ=__g.cm-3。(列式即可)
【答案】![]() Ni、Ge、Se Be与Mg、Mg与Ca核电荷数相差8,原子核对核外电子的引力增加较小,而增加一个电子层时原子半径增大幅度较大;Ca与Sr、Sr与Ba核电荷数相差18,原子核对核外电子的引力增加较大,而增加一个电子层时原子半径增大幅度较小 随着原子序数的递增,原子半径依次增大,原子核对最外层电子的引力减弱,第一电离势依次减小 sp2 易溶 草酸能形成分子间氢键,熔点较高;液溴分子间只存在范德华力,熔点较低 6
Ni、Ge、Se Be与Mg、Mg与Ca核电荷数相差8,原子核对核外电子的引力增加较小,而增加一个电子层时原子半径增大幅度较大;Ca与Sr、Sr与Ba核电荷数相差18,原子核对核外电子的引力增加较大,而增加一个电子层时原子半径增大幅度较小 随着原子序数的递增,原子半径依次增大,原子核对最外层电子的引力减弱,第一电离势依次减小 sp2 易溶 草酸能形成分子间氢键,熔点较高;液溴分子间只存在范德华力,熔点较低 6 ![]()
【解析】
(1)基态Ti原子的电子排布式为1s22s22p63s23p63d24s2,由此可画出价电子排布图,同周期元素中,基态原子未成对电子数与Ti相同的元素,其价电子排布可能为3d84s2、4s24p2、4s24p4。
(2)①由上表数据可知,相邻元素原子半径差值r(Be-Mg)、r(Mg-Ca)明显大于r(Ca-Sr)、r(Sr-Ba),可从核电荷数的变化、原子半径的变化进行解析。
②由上表数据可知,随原子序数的递增,第IIA族元素的第一电离势依次减小,从原子半径变化及原子核对外层电子的吸引力解释原因。
(3)①草酸分子中,碳原子的价层电子对数为3,由此可得出杂化方式。
②草酸分子中含有水溶性基团羧基,由此可预测草酸在水和乙醇中的溶解性。
③草酸和液溴都形成分子晶体,草酸分子间能形成氢键,熔点高于液溴。
(4)从晶胞中Ti原子周围O原子的分布,可确定其配位数;由晶胞参数可求出体积,再利用晶胞中所含原子数计算质量,最后求出钛酸钡晶体的密度。
(1)基态Ti原子的电子排布式为1s22s22p63s23p63d24s2,由此可画出价电子排布图为![]() ,同周期元素中,基态原子未成对电子数与Ti相同的元素,其价电子排布可能为3d84s2、4s24p2、4s24p4,则对应元素为Ni、Ge、Se。答案为:
,同周期元素中,基态原子未成对电子数与Ti相同的元素,其价电子排布可能为3d84s2、4s24p2、4s24p4,则对应元素为Ni、Ge、Se。答案为:![]() ;Ni、Ge、Se;
;Ni、Ge、Se;
(2)①由上表数据可知,相邻元素原子半径差值r(Be-Mg)、r(Mg-Ca)明显大于r(Ca-Sr)、r(Sr-Ba),可从核电荷数的变化、原子半径的变化进行解析,其原因为Be与Mg、Mg与Ca核电荷数相差8,原子核对核外电子的引力增加较小,而增加一个电子层时原子半径增大幅度较大;Ca与Sr、Sr与Ba核电荷数相差18,原子核对核外电子的引力增加较大,而增加一个电子层时原子半径增大幅度较小。答案为:Be与Mg、Mg与Ca核电荷数相差8,原子核对核外电子的引力增加较小,而增加一个电子层时原子半径增大幅度较大;Ca与Sr、Sr与Ba核电荷数相差18,原子核对核外电子的引力增加较大,而增加一个电子层时原子半径增大幅度较小;
②由上表数据可知,随原子序数的递增,第IIA族元素的第一电离势依次减小,从原子半径变化及原子核对外层电子的吸引力解释,其原因为随着原子序数的递增,原子半径依次增大,原子核对最外层电子的引力减弱,第一电离势依次减小。答案为:随着原子序数的递增,原子半径依次增大,原子核对最外层电子的引力减弱,第一电离势依次减小;
(3)①草酸分子中,碳原子的价层电子对数为3,则碳原子的杂化方式为sp2。答案为:sp2;
②草酸分子中含有水溶性基团羧基,由此可预测草酸易溶于水和乙醇。答案为:易溶;
③草酸和液溴都形成分子晶体,草酸分子间能形成氢键,由此确定草酸熔点高于液溴的原因是草酸能形成分子间氢键,熔点较高;液溴分子间只存在范德华力,熔点较低。答案为:草酸能形成分子间氢键,熔点较高;液溴分子间只存在范德华力,熔点较低;
(4)晶胞中,Ti原子周围距离最近的O原子位于棱的中点,由此可确定其配位数为![]() =6;在晶胞内,含有1个Ba离子,含Ti原子数为8×
=6;在晶胞内,含有1个Ba离子,含Ti原子数为8×![]() =1,O原子数为12×
=1,O原子数为12×![]() =3,则钛酸钡晶体的密度ρ=
=3,则钛酸钡晶体的密度ρ=![]() =
=![]() g.cm-3。答案为:6;
g.cm-3。答案为:6;![]() 。
。

【题目】下列实验装置能达到实验目的的是( )
|
|
|
|
A.测定一定时间内生成 H2的反应速率 | B.可以进行中和热的测定实验 | C.比较温度对化学反应速率的影响 | D.比较Cu2+、Fe3+对 H2O2分解速率的影响 |
A.AB.BC.CD.D