题目内容
【题目】下列实验装置能达到实验目的的是( )
|
|
|
|
A.测定一定时间内生成 H2的反应速率 | B.可以进行中和热的测定实验 | C.比较温度对化学反应速率的影响 | D.比较Cu2+、Fe3+对 H2O2分解速率的影响 |
A.AB.BC.CD.D
【答案】A
【解析】
A.可以根据秒表测出生成一定体积氢气的时间,故可以算出反应速率,A正确;
B.中和热的测定,温度计应放在反应溶液中,B错误;
C.二氧化氮为红棕色气体,四氧化二氮为无色气体,容器内存在:2NO2![]() N2O4,
N2O4,![]() <O,升高温度,平衡逆向移动,NO2含量增多,颜色加深,说明的是温度对平衡移动的影响,而不是温度对速率的影响,C错误;
<O,升高温度,平衡逆向移动,NO2含量增多,颜色加深,说明的是温度对平衡移动的影响,而不是温度对速率的影响,C错误;
D.还有氯离子和硫酸根离子不同,故不能比较铜离子和铁离子对双氧水的分解速率的影响,D错误。
答案选A。

 阅读快车系列答案
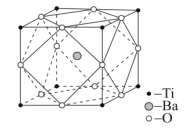
阅读快车系列答案【题目】钛酸钡粉体是电子陶瓷元器件的重要基础原料。工业上以TiCl4、BaCO3、H2C2O4等物质为原料制备草酸氧钛钡晶体[BaTiO(C2O4)2·4H2O],再高温煅烧制得钛酸钡粉体。请回答下列问题:
(1)基态Ti原子的价电子排布图为__,同周期元素中,基态原子未成对电子数与Ti相同的元素有___(填元素符号)。
(2)第IIA族(碱土金属)元素的原子序数、原子半径、第一电离势(从元素的气态基态原子中将一个电子移至无穷远处时所需做的功)如下表所示。
元素 | 原子序数 | 原子半径/pm | 每一电离势/eV |
Be | 4 | 89 | 9.32 |
Mg | 12 | 136 | 7.644 |
Ca | 20 | 174 | 6.111 |
Sr | 38 | 191 | 5.692 |
Ba | 56 | 198 | 5.21 |
①由上表数据可知,相邻元素原子半径差值r(Be-Mg)、r(Mg-Ca)明显大于r(Ca-Sr)、r(Sr-Ba),试解释其原因__。
②由上表数据可知,随原子序数的递增,第IIA族元素的第一电离势依次减小,试解释其原因__。
(3)已知草酸分子的结构简式为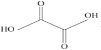 。
。
①草酸分子中,碳原子的杂化方式为__。
②由此结构简式可预测草酸__(填“难溶”“微溶”或“易溶”)于水和乙醇。
③已知草酸和液溴的相关数据如下,草酸熔点高于液溴的原因是__。
名称 | 化学式 | 相对子质量 | 熔点 |
草酸 | H2C2O4 | 90 | 101℃ |
液溴 | Br2 | 160 | -7.2℃ |
(4)设NA是阿伏加德罗常数的值,已知钛酸钡的立方晶胞结构如图所示,晶胞中Ti原子的配位数为__,其晶胞参数约为apm,钛酸钡晶体的密度ρ=__g.cm-3。(列式即可)