��Ŀ����
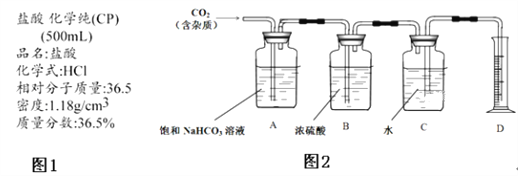
����Ŀ��ijѧϰС��̽�����Ļ�ԭ�Լ������������ʣ�����ͼװ�ý���ʵ��(ͼ�мг�װ������ȥ)����B�����������������������ȣ��ٹ����������֪����ˮ�Ȼ��ƿ����հ�����ˮ���ش��������⣺
(1)B�з�����Ӧ�Ļ�ѧ����ʽ��______________________________��
(2)֤������������������������________________����Ӧ�ķ���ʽ��________________��
(3)E��ͭ������Ӧ�����ӷ���ʽ��________________________________��
(4)E�л���ͨ�������Ŀ����____________________________________��
���𰸡�4NH3��5O2![]() 4NO��6H2O D�й��ƿ���к���ɫ���� 2NO+O2===2NO2 3Cu��8H����2
4NO��6H2O D�й��ƿ���к���ɫ���� 2NO+O2===2NO2 3Cu��8H����2![]() ===3Cu2����2NO����4H2O ʹһ���������ת��Ϊ�������������������Ⱦ
===3Cu2����2NO����4H2O ʹһ���������ת��Ϊ�������������������Ⱦ
��������
�������������ɵ�NO�Ϳ����е�O2��Ӧ����NO2��NO2������ˮ����HNO3��Cu������ϡ��������NO����Ӧ��β��NO�Ϳ����Ļ��������NaOH��Һ���ա�
(1)B�з����ķ�Ӧ�ǰ��Ĵ�������Ӧ 4NH3��5O2![]() 4NO��6H2O��
4NO��6H2O��
(2)�����������IJ���һ������������������2NO��O2===2NO2��D�й��ƿ���к���ɫ���������
(3)��E�У����ɵĶ���������ˮ��Ӧ3NO2��H2O = 2HNO3��NO��ͭ�����ᷴӦ3Cu��8HNO3(ϡ) = 3Cu(NO3)2��2NO����4H2O�����ӷ���ʽΪ3Cu��8H����2![]() =3Cu2����2NO����4H2O��
=3Cu2����2NO����4H2O��
(4)Ϊʹһ���������ת��Ϊ�������������������Ⱦ����E��Ҫ����ͨ�������

 ���������ʱ��ѵϵ�д�
���������ʱ��ѵϵ�д� �㽭�¿γ���άĿ�������ʱ��ѵϵ�д�
�㽭�¿γ���άĿ�������ʱ��ѵϵ�д� ��������ϵ�д�
��������ϵ�д� ���ɶ���ܲ��¿�ֱͨ�߿�ϵ�д�
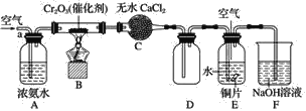
���ɶ���ܲ��¿�ֱͨ�߿�ϵ�д�����Ŀ��ijС���о�NH4Cl��CuO�ķ�Ӧ����������ʵ��(����װ����)��
ʵ�� | �� | �� |
װ�� |
|
|
���� | �����Թܣ��������̣��Թܿ��а�ɫ���壻�Թ�����ˮ���ɣ��������ȣ���ɫ������������ղ��ֱ�Ϊ��ɫ | ��ϸ�����ܿڼ��������ȣ�Ѹ�ٴ�ֱ���� NH4Cl�����У�һ��ʱ���ȡ�������ܣ��ܿڴ�������ɫ���� |
����⣬ʵ����еĻ�ɫ���庬��CuCl��CuCl2��ʵ����е�����ɫ����ΪCu��
(1)ʵ������Թܿڵİ�ɫ������______��
(2)ʵ����к�ɫ������������ղ��ֹ����Ϊ��ɫ�Ĺ����У����������±仯��
![]()
��(NH4)2CuCl4�������ȷֽ�Ļ�ѧ����ʽ��______��
�ڶ�������X���������¼��裺
����X��NH4Cl��
��Ӧ����ʽΪ��________________________________(��������)
����X��______��������______��
(3)ʵ����ʵ��������ͬ�����ܵ�ԭ����______(�г�2��)��
(4)NH4Cl��Һ��CuO��Ӧ��
ʵ��� ��CuO��ĩ�м���0.1 mol��L1 NH4Cl��Һ������һ��ʱ����岿���ܽ⣬��������ɫ�仯����Һ��Ϊ��ɫ��
���ϣ������������ˮ��Һ�е���ɫ��Cu2+��ɫ��Cu(NH3)2+��Cu(NH3)42+����ɫ
����Cu(NH3)2+![]() Cu2++NH3 Cu(NH3)42+
Cu2++NH3 Cu(NH3)42+![]() Cu2++4NH3
Cu2++4NH3
�����ʵ��֤��ʵ���õ�����ɫ��Һ�д���Cu(NH3)2+��Cu(NH3)42+��
ʵ�鷽����______��
��ʵ�����δ�۲쵽NH4Cl��Һ��CuO����������ԭ��Ӧ�IJ�����ܵ�ԭ����______(�г�1�㼴��)��
����Ŀ������![]() ��
��![]() Ϊԭ�Ͽ��Ʊ��������ף����Ʊ�װ����ͼ��ʾ(�г�װ����ȥ)��
Ϊԭ�Ͽ��Ʊ��������ף����Ʊ�װ����ͼ��ʾ(�г�װ����ȥ)��
��֪![]() �����������������±���
�����������������±���
�۵� | �е� | ����������ѧ���� | |
|
|
|
|
|
|
|
(1)�����ҵ�������__________��
(2)ʵ��������������Ľ�ˮ��Ϊ__________(ѡ�![]() ����
����![]() ��)�ڡ�
��)�ڡ�
(3)װ��B��������__________(����)��
a.������� b.��עŨ���� c.�۲����������ٶ� d.������ѹ
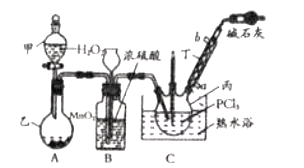
(4)����װ�ñ�������δ���д�����и���Ӧ�Ļ�ѧ����ʽ______________________________��
(5)�Ʊ�������������PCl3�ⶨ���ȵķ������£�Ѹ�ٳ�ȡ![]() ��Ʒ��ˮ����ȫ�����
��Ʒ��ˮ����ȫ�����![]() ��Һ��ȡ��
��Һ��ȡ��![]() �������
�������![]() ����Һ����ַ�Ӧ������
����Һ����ַ�Ӧ������![]() ��Һ�ζ������ĵ⣬�յ�ʱ����
��Һ�ζ������ĵ⣬�յ�ʱ����![]() ��Һ��
��Һ��
��֪��![]() ��
��![]() ������ⶨ������û��������Ӧ�������������ݣ��ò�Ʒ��
������ⶨ������û��������Ӧ�������������ݣ��ò�Ʒ��![]() (��Է�������Ϊ137��5)�����������ļ���ʽΪ__________%��(�ú�
(��Է�������Ϊ137��5)�����������ļ���ʽΪ__________%��(�ú�![]() �Ĵ���ʽ��ʾ)
�Ĵ���ʽ��ʾ)