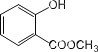
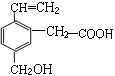
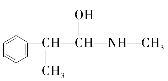题目内容
【题目】氯及其化合物在工农业生产和人类生活中有着重要的作用。回答下列问题:
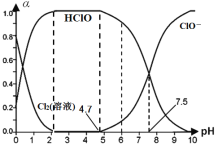
(1)25℃时将氯气溶于水形成“氯气-氯水”体系,该体系存在多个含氯元素的平衡关系,其中之一为:Cl2(溶液)+H2O![]() HClO+H++Cl-,体系中Cl2(溶液)、HClO和ClO-三者的物质的量分数(α)随pH(酸碱度)变化的关系如图所示。已知HClO的杀菌能力比ClO-强,用氯气处理饮用水时,杀菌效果最强的pH范围为__(填字母)。
HClO+H++Cl-,体系中Cl2(溶液)、HClO和ClO-三者的物质的量分数(α)随pH(酸碱度)变化的关系如图所示。已知HClO的杀菌能力比ClO-强,用氯气处理饮用水时,杀菌效果最强的pH范围为__(填字母)。
A.0~2 B.2~4.7 C.4.7~7.5 D.7.5~10
(2)写出次氯酸光照分解的化学方程式___,如果在家中直接使用自来水养金鱼,除去其中残留的次氯酸可采取的简易措施为__。
(3)NaClO、NaClO2、ClO2等含氯化合物都是常见的消毒剂,这是因为它们都具有强氧化性。
①写出工业上用氯气和NaOH溶液生产消毒剂NaClO的化学方程式___;
②84消毒液(主要成分是NaClO)与洁厕灵(主要成分是盐酸)混在一起使用会产生有毒气体Cl2,其反应的离子方程式为__;
③NaClO2中Cl元素化合价为__;
④ClO2的杀菌效果比Cl2好,等物质的量的ClO2杀菌效果是Cl2的__倍(杀菌效果与单位物质的量的氧化剂得电子的物质的量有关,ClO2与Cl2消毒杀菌后均被还原为Cl-)。
【答案】B 2HClO![]() 2HCl+O2↑ 用容器盛放,在太阳光下曝晒一段时间 Cl2+2NaOH=NaCl+NaClO+H2O 2H++Cl-+ClO-=Cl2↑+H2O +3 2.5
2HCl+O2↑ 用容器盛放,在太阳光下曝晒一段时间 Cl2+2NaOH=NaCl+NaClO+H2O 2H++Cl-+ClO-=Cl2↑+H2O +3 2.5
【解析】
图中信息告诉我们,在氯水中,具有杀菌能力的微粒主要是Cl2和HClO,随着溶液pH的不断增大,α(Cl2)不断减小,当pH=2时,α(Cl2)接近于0;随着溶液pH的不断增大,α(HClO)不断增大,当pH=2时,α(HClO)达到最大值;当pH升高到4.7时,α(HClO)开始减小,当pH接近10时,α(HClO)=0;从pH=4.7开始,α(ClO-)开始增大,pH=10时,α(ClO-)达最大值。
(1)根据题目信息得知HClO的杀菌能力比ClO-强,依据图中信息可知pH为2~4.7时HClO含量最多,因此用氯气处理饮用水时,杀菌效果最强的pH范围为2~4.7,应选B。答案为:B;
(2)次氯酸光照分解生成盐酸和氧气,化学方程式为2HClO![]() 2HCl + O2↑,由于次氯酸见光易分解,如果在家中直接使用自来水养金鱼,除去其中残留的次氯酸可采取的简易措施为用容器盛放,在太阳光下曝晒一段时间。答案为:2HClO
2HCl + O2↑,由于次氯酸见光易分解,如果在家中直接使用自来水养金鱼,除去其中残留的次氯酸可采取的简易措施为用容器盛放,在太阳光下曝晒一段时间。答案为:2HClO![]() 2HCl+O2↑;用容器盛放,在太阳光下曝晒一段时间;
2HCl+O2↑;用容器盛放,在太阳光下曝晒一段时间;
(3)①工业上用氯气和NaOH溶液生产消毒剂NaClO的化学方程式为Cl2 + 2NaOH == NaCl + NaClO + H2O。答案为:Cl2+2NaOH=NaCl+NaClO+H2O;
②NaClO与盐酸反应生成氯气、氯化钠和水,离子方程式为2H+ + Cl- + ClO- == Cl2↑ + H2O。答案为:2H++Cl-+ClO-=Cl2↑+H2O;
③NaClO2中Na显+1价,O显-2价,则Cl元素化合价为+3。答案为:+3;
④根据题中信息已知杀菌效果与单位物质的量的氧化剂得电子的物质的量有关,ClO2与Cl2消毒杀菌后均被还原为Cl-,1molClO2能够得到5mol电子,1molCl2能够得到2mol电子,因此等物质的量的ClO2杀菌效果是Cl2的2.5倍。答案为:2.5。