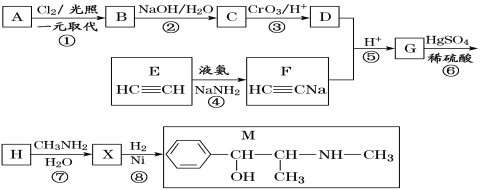
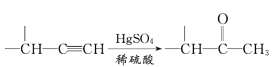
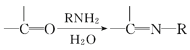
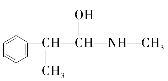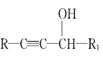题目内容
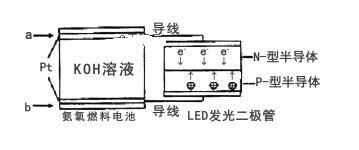
【题目】MnO2和Zn是制造普通干电池的重要原料,现用软锰矿(主要成分为MnO2)和闪锌矿(主要成分为ZnS)制备MnO2和Zn的工艺流程如图:
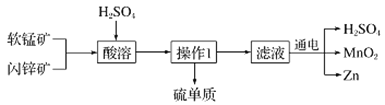
下列说法不正确的是( )
A.干电池是一种将化学能转变为电能的装置
B.酸溶时,ZnS作还原剂,每析出12.8gS沉淀,共转移0.8mol电子
C.通电电解时MnO2在阳极处生成,电极反应为:Mn2+-2e-+2H2O═MnO2+4H+
D.原料硫酸可以循环使用,且可用盐酸代替硫酸进行酸溶
【答案】D
【解析】
A. 干电池是一种化学电源,能将化学能转变为电能,故A正确;
B. 酸溶时,MnO2与ZnS发生氧化还原反应,硫元素化合价由-2升高为0,生成硫单质,所以ZnS作还原剂,每析出12.8gS沉淀,共转移电子![]() ,故B正确;
,故B正确;
C. 通电电解时Mn 2+失电子生成MnO2,MnO2在阳极处生成,电极反应为:Mn2+-2e-+2H2O═MnO2+4H+,故C正确;
D. 二氧化锰能把氯离子氧化为氯气,不能用盐酸代替硫酸进行酸溶,故D错误;
故选D。

【题目】能源危机是当前全球性的问题,“开源节流”是应对能源危机的重要举措。
(1)下列做法有助于能源“开源节流”的是____(填序号)。
a.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
b.大力开采煤、石油和天然气以满足人们日益增长的能源需求
c.开发太阳能、水能、风能、地热能等新能源,减少使用煤、石油等化石燃料
d.减少资源消耗,增加资源的重复使用、资源的循环再生
(2)科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:2NO+2CO![]() 2CO2+N2△H<0。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
2CO2+N2△H<0。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
C(NO)(×10-4mol·L-1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
C(CO)(×10-3mol·L-1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
前2s内的平均反应速率v(N2)=______;达到平衡时,NO的转化率为_____,气相中NO所占的体积分数为______。