题目内容
【题目】表为元素周期表的一部分,请回答有关问题:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
4 | ⑨ | ⑩ |
(1)画出⑧的元素原子结构示意图__________。
(2)表中非金属性最强的元素阴离子与④的离子半径大小关系为(用离子符号表示)__________。元素④和⑩形成的化合物为__________化合物(填“离子”或“共价”)
(3)表中某元素能形成两性氢氧化物,该氢氧化物与⑨最高价氧化物的水化物反应的离子方程式为_________________________________。
(4)元素⑦的非金属性强于⑥,写出支持该结论的一个化学方程式__________________
(5)请设计一个实验方案,比较③、④元素的单质还原性的强弱,写出实验操作步骤、现象及结论:______________________________________________________________________________________________________________________________________________________。
(6)下表中的数据是破坏(或形成)1 mol物质中的化学键所吸收(或释放)的能量(kJ)。这一数据的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热,回答下列问题:
化学键 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
能量(kJ) | 243 | 193 | 151 | 432 | 366 | 298 | 436 |
反应Br2 + H2=2HBr,当生成2 mol HBr时放出_____________ kJ能量。
【答案】 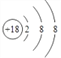 F- > Al3+ 共价 Al(OH)3+OH— == [Al(OH)4]— H2S+Cl2=2HCl+S 方法一:将相同大小相同表面积的镁片和铝片分别投入到沸水(或相同浓度的盐酸溶液中)中,观察实验现象,若镁条与沸水(或相同浓度盐酸)反应剧烈,则证明③比④单质还原性强。方法二:将相同大小相同表面积的镁片和铝片投入到沸水,向反应后的溶液中各滴加几滴无色酚酞溶液,若镁条与沸水反应后溶液变红,铝条与沸水反应后溶液不变色,则证明③比④单质还原性强 103
F- > Al3+ 共价 Al(OH)3+OH— == [Al(OH)4]— H2S+Cl2=2HCl+S 方法一:将相同大小相同表面积的镁片和铝片分别投入到沸水(或相同浓度的盐酸溶液中)中,观察实验现象,若镁条与沸水(或相同浓度盐酸)反应剧烈,则证明③比④单质还原性强。方法二:将相同大小相同表面积的镁片和铝片投入到沸水,向反应后的溶液中各滴加几滴无色酚酞溶液,若镁条与沸水反应后溶液变红,铝条与沸水反应后溶液不变色,则证明③比④单质还原性强 103
【解析】根据元素在周期表中的相对位置可知①~⑩分别是N、F、Mg、Al、Si、S、Cl、Ar、K、Br。则
(1)Ar的原子序数是18,元素原子结构示意图为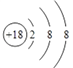 。(2)氟离子和铝离子的核外电子排布相同,离子半径随原子序数的增大而减小,则离子半径大小关系为F- >Al3+。元素④和⑩形成的化合物为溴化铝,由于氯元素非金属性强于溴元素,而氯化铝是共价化合物,则溴化铝属于共价化合物;(3)表中某元素能形成两性氢氧化物是Al,该氢氧化物与⑨最高价氧化物的水化物KOH反应的离子方程式为Al(OH)3+OH- == [Al(OH)4]-。(4)氯气能把H2S氧化为单质S,说明元素⑦的非金属性强于⑥,反应的化学方程式为H2S+Cl2=2HCl+S;(5)金属性越强,与水或酸反应的越剧烈,则比较③、④元素的单质还原性的强弱的实验操作步骤、现象及结论为:将相同大小相同表面积的镁片和铝片分别投入到沸水(或相同浓度的盐酸溶液中)中,观察实验现象,若镁条与沸水(或相同浓度盐酸)反应剧烈,则证明③比④单质还原性强;(6)反应热等于断键吸收的能量和形成化学键所放出的能量的差值,则反应Br2 + H2=2HBr的焓变是(193+436-2×366)kJ/mol=-103kJ/mol,所以当生成2 mol HBr时放出103 kJ能量。
。(2)氟离子和铝离子的核外电子排布相同,离子半径随原子序数的增大而减小,则离子半径大小关系为F- >Al3+。元素④和⑩形成的化合物为溴化铝,由于氯元素非金属性强于溴元素,而氯化铝是共价化合物,则溴化铝属于共价化合物;(3)表中某元素能形成两性氢氧化物是Al,该氢氧化物与⑨最高价氧化物的水化物KOH反应的离子方程式为Al(OH)3+OH- == [Al(OH)4]-。(4)氯气能把H2S氧化为单质S,说明元素⑦的非金属性强于⑥,反应的化学方程式为H2S+Cl2=2HCl+S;(5)金属性越强,与水或酸反应的越剧烈,则比较③、④元素的单质还原性的强弱的实验操作步骤、现象及结论为:将相同大小相同表面积的镁片和铝片分别投入到沸水(或相同浓度的盐酸溶液中)中,观察实验现象,若镁条与沸水(或相同浓度盐酸)反应剧烈,则证明③比④单质还原性强;(6)反应热等于断键吸收的能量和形成化学键所放出的能量的差值,则反应Br2 + H2=2HBr的焓变是(193+436-2×366)kJ/mol=-103kJ/mol,所以当生成2 mol HBr时放出103 kJ能量。




