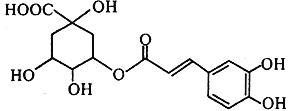
题目内容
【题目】下列实验操作中正确的是( )
A. 蒸馏操作时,温度计水银球靠近蒸馏烧瓶的底部,且向蒸馏液体中加入几块沸石,以防止暴沸
B. 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热
C. 焰色反应每次实验都要先用稀硫酸洗净铂丝
D. 过滤、结晶、萃取、分液和蒸馏等都是常用的分离混合物的方法
【答案】D
【解析】A、蒸馏操作时,温度计水银球应在蒸馏烧瓶的支管口处,A错误;B、蒸发操作时,当有大量固体出现时,停止加热,用余热把剩余的液体蒸干,B错误;C、焰色反应每次实验都要先用稀盐酸洗净铂丝,C错误;D、过滤、结晶、萃取、分液和蒸馏等都是常用的分离混合物的方法,D正确。答案选D。

 阅读快车系列答案
阅读快车系列答案【题目】表为元素周期表的一部分,请回答有关问题:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
4 | ⑨ | ⑩ |
(1)画出⑧的元素原子结构示意图__________。
(2)表中非金属性最强的元素阴离子与④的离子半径大小关系为(用离子符号表示)__________。元素④和⑩形成的化合物为__________化合物(填“离子”或“共价”)
(3)表中某元素能形成两性氢氧化物,该氢氧化物与⑨最高价氧化物的水化物反应的离子方程式为_________________________________。
(4)元素⑦的非金属性强于⑥,写出支持该结论的一个化学方程式__________________
(5)请设计一个实验方案,比较③、④元素的单质还原性的强弱,写出实验操作步骤、现象及结论:______________________________________________________________________________________________________________________________________________________。
(6)下表中的数据是破坏(或形成)1 mol物质中的化学键所吸收(或释放)的能量(kJ)。这一数据的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热,回答下列问题:
化学键 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
能量(kJ) | 243 | 193 | 151 | 432 | 366 | 298 | 436 |
反应Br2 + H2=2HBr,当生成2 mol HBr时放出_____________ kJ能量。