题目内容
【题目】用NH3催化还原NxOy可以消除氮氧化物的污染.已知:反应I:4NH3(g)+6NO(g)5N2(g)+6H2O(l)△H1
反应II:2NO(g)+O2(g)2NO2(g)△H2 (且|△H1|=2|△H2|)
反应III:4NH3(g)+6NO2(g)5N2(g)+3O2(g)+6H2O(l)△H3
反应I和反应II在不同温度时的平衡常数及其大小关系如下表
温度/K | 反应I | 反应II | 已知: |
298 | K1 | K2 | |
398 | K1′ | K2′ |
(1)推测反应III是反应(填“吸热”或“放热”)
(2)相同条件下,反应I在2L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图1所示.①计算0~4分钟在A催化剂作用下,反应速率v(NO)= .
②下列说法正确的是 .
A.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
B.增大压强能使反应速率加快,是因为增加了活化分子百分数
C.单位时间内H﹣O键与N﹣H键断裂的数目相等时,说明反应已经达到平衡
D.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
(3)一定条件下,反应II达到平衡时体系中n(NO):n(O2):n(NO2)=2:1:2.在其它条件不变时,再充入NO2气体,分析NO2体积分数﹣﹣φ(NO2)的变化情况:(填“变大”、“变小”或“不变”)恒温恒压容器,φ(NO2);恒温恒容容器,φ(NO2) .
(4)一定温度下,反应III在容积可变的密闭容器中达到平衡,此时容积为3L,c(N2)与反应时间t变化曲线X如图2所示,若在t1时刻改变一个条件,曲线X变为曲线Y或曲线Z.则:①变为曲线Y改变的条件是 . 变为曲线Z改变的条件是 . 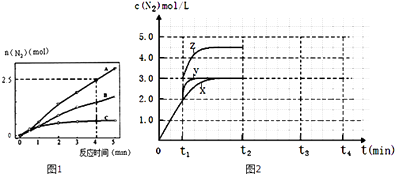
②若t2降低温度,t3达到平衡,请在上图中画出曲线X在t2﹣t4内 c(N2)的变化曲线 .
【答案】
(1)吸热
(2)0.375mol?L﹣1min﹣1;CD
(3)不变;变大
(4)加入催化剂;将容器的体积快速压缩至2L;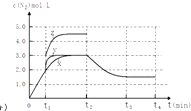
【解析】解:(1)已知K1>K1′,说明随温度升高,K减小,则反应Ⅰ为放热反应,△H1<0;K2>K2′,说明随温度升高,K减小,则反应II为放热反应,△H2<0;反应I﹣反应II×3得到反应III,则△H3=△H1﹣3△H2 , 已知|△H1|=2|△H2|,所以△H3=△H1﹣3△H2=|△H2|>0,即反应III为吸热反应,所以答案是:吸热;(2)①已知4分钟时氮气为2.5mol,则消耗的NO为3mol,所以v(NO)= ![]() =
= ![]() =0.375molL﹣1min﹣1 , 所以答案是:0.375molL﹣1min﹣1;②A.相同时间内生成的氮气的物质的量越多,则反应速率越快,活化能越低,所以该反应的活化能大小顺序是:Ea(A)<Ea(B)<Ea(C),故A错误;B.增大压强能使反应速率加快,是因为增大了活化分子数,而活化分子百分数不变,故B错误;C.单位时间内H﹣O键断裂表示逆速率,N﹣H键断裂表示正速率,单位时间内H﹣O键与N﹣H键断裂的数目相等时,则消耗的NH3和消耗的水的物质的量之比为4:6,则正逆速率之比等于4:6,说明反应已经达到平衡,故C正确;D.该反应为放热反应,恒容绝热的密闭容器中,反应时温度会升高,则K会减小,当K值不变时,说明反应已经达到平衡,故D正确;所以答案是:CD;(3)一定条件下,反应II2NO(g)+O2(g)2NO2(g)达到平衡时体系中n(NO):n(O2):n(NO2)=2:1:2.在其它条件不变时,恒温恒压条件下,再充入NO2气体,则与原来的平衡为等效平衡,则NO2体积分数与原来平衡相同;若恒温恒容容器中,再充入NO2气体,容器中压强增大,与原来平衡相比较,平衡正向移动,则NO2体积分数变大;所以答案是:不变;变大;(4)①分析图象可知曲线X变化为曲线Y是缩短反应达到平衡的时间,最后达到相同平衡状态,反应中体积是可变的,已知是恒压容器,说明改变的是加入了催化剂,当曲线X变为曲线Z时N2物质的量浓度增大,可变容器中气体体积和浓度成反比,曲线X,体积为3L,N2浓度为3mol/L,改变条件当曲线X变为曲线Z时,N2浓度为4.5mol/L,则体积压缩体积为:3:V=4.5:3,V=2L,所以将容器的体积快速压缩至2L符合;所以答案是:加入催化剂;将容器的体积快速压缩至2L;②反应III为吸热反应,若t2降低温度,则平衡逆向移动,氮气的浓度减小,在t3达到平衡,曲线X在t2﹣t4内 c(N2)的变化曲线为
=0.375molL﹣1min﹣1 , 所以答案是:0.375molL﹣1min﹣1;②A.相同时间内生成的氮气的物质的量越多,则反应速率越快,活化能越低,所以该反应的活化能大小顺序是:Ea(A)<Ea(B)<Ea(C),故A错误;B.增大压强能使反应速率加快,是因为增大了活化分子数,而活化分子百分数不变,故B错误;C.单位时间内H﹣O键断裂表示逆速率,N﹣H键断裂表示正速率,单位时间内H﹣O键与N﹣H键断裂的数目相等时,则消耗的NH3和消耗的水的物质的量之比为4:6,则正逆速率之比等于4:6,说明反应已经达到平衡,故C正确;D.该反应为放热反应,恒容绝热的密闭容器中,反应时温度会升高,则K会减小,当K值不变时,说明反应已经达到平衡,故D正确;所以答案是:CD;(3)一定条件下,反应II2NO(g)+O2(g)2NO2(g)达到平衡时体系中n(NO):n(O2):n(NO2)=2:1:2.在其它条件不变时,恒温恒压条件下,再充入NO2气体,则与原来的平衡为等效平衡,则NO2体积分数与原来平衡相同;若恒温恒容容器中,再充入NO2气体,容器中压强增大,与原来平衡相比较,平衡正向移动,则NO2体积分数变大;所以答案是:不变;变大;(4)①分析图象可知曲线X变化为曲线Y是缩短反应达到平衡的时间,最后达到相同平衡状态,反应中体积是可变的,已知是恒压容器,说明改变的是加入了催化剂,当曲线X变为曲线Z时N2物质的量浓度增大,可变容器中气体体积和浓度成反比,曲线X,体积为3L,N2浓度为3mol/L,改变条件当曲线X变为曲线Z时,N2浓度为4.5mol/L,则体积压缩体积为:3:V=4.5:3,V=2L,所以将容器的体积快速压缩至2L符合;所以答案是:加入催化剂;将容器的体积快速压缩至2L;②反应III为吸热反应,若t2降低温度,则平衡逆向移动,氮气的浓度减小,在t3达到平衡,曲线X在t2﹣t4内 c(N2)的变化曲线为 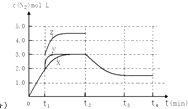 ,所以答案是:
,所以答案是: 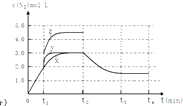 .
.
【考点精析】认真审题,首先需要了解反应速率的定量表示方法(反应速率的单位:mol/(L·min)或mol/(L·s) v=△c-△t),还要掌握化学平衡状态本质及特征(化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效))的相关知识才是答题的关键.

 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案【题目】X、T、Y、Z为1﹣36号元素,且原子序数依次增大,四种元素的性质或结构信息如表.请根据信息回答下列问题.
元素 | T | X | Y | Z |
性质结构信息 | 原子核外s电子总数等于p电子总数;人体内含量最多的元素,且其单质是常见的助燃剂 | 单质为双原子分子,分子中含有3对共用电子对,常温下单质性质稳定,但其原子较活泼 | 第3周期元素的简单离子中半径最小 | 第4周期元素,M电子层为全充满状态,最外层只有一个电子的原子 |
(1)写出元素T的离子结构示意图;写出元素X的气态氢化物的电子式;X形成的单质分子,含个σ键,个π键.写出Z元素原子的外围电子排布式;元素Y的原子核外共有种形状不同的电子云.
(2)Y单质与氢氧化钠溶液反应的离子方程式: .
(3)元素T与氟元素相比,非金属性较强的是(用元素符号表示),下列表述中能证明这一事实的是(填序号字母).
a.常温下氟气的颜色比T单质的颜色深
b.氟气与T的氢化物剧烈反应,产生T的单质
c.氟与T形成的化合物中T元素呈正价态
d.比较两元素的单质与氢气化合时得电子的数目.
【题目】氨的合成原理为:N2(g)+3H2(g)2NH3(g);△H=﹣92.4KJmol﹣1 . 现在500℃、20MPa时,将N2、H2置于一个容积为2L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图. 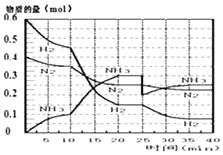
回答下列问题:
(1)10min内以NH3表示的平均反应速率;
(2)在10~20min内:NH3浓度变化的原因可能是;
A.加了催化剂
B.缩小容器体积
C.降低温度
D.增加NH3物质的量
(3)第1次平衡的时间范围为: , 第1次平衡:平衡常数K1=(带数据的表达式),
(4)在反应进行至25min时:
①曲线发生变化的原因:
②达第二次平衡时,新平衡的平衡常数K2K1(填“大于”、“等于”、“小于”);
(5)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:N2(g)+3H2O(1)2NH3(g)+ ![]() O2(g);△H=a kJmol﹣1
O2(g);△H=a kJmol﹣1
进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如表:
T/K | 303 | 313 | 323 |
NH3生成量/(10﹣6mol) | 4.8 | 5.9 | 6.0 |
此合成反应的a0;△S0,(填“>”、“<”或“=”).