题目内容
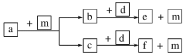
【题目】短周期元素W、X、Y、Z的原子序数依次递增,a、b、c、d、e、f是由这些元素组成的化合物,d为淡黄色的离子化合物,m为元素Y的单质,通常为无色无味的气体。上述物质的转化关系如图所示。下列说法正确的是
A.原子半径:W<X<Y<Z
B.阴离子的还原性:Y>W
C.图中物质的转化过程均为氧化还原反应
D.a一定只由W、X两种元素组成
【答案】C
【解析】
短周期元素 W、X、Y、Z 的原子序数依次递增,a、b、c、d、e、f 是由这些元素组成的化合物,d为淡黄色的离子化合物,d为Na2O2,m 为元素 Y 的单质,通常为无色无味的气体,结合图中转化可知,m为O2,b、c分别为CO2、H2O中的一种,对应的e、f分别为Na2CO3、NaOH中的一种,则a为烃或烃的含氧衍生物,结合原子序数可知,W为H,X为C,Y为O,Z为Na。
根据上述分析可知a为烃或烃的含氧衍生物,m为O2,b、c分别为CO2、H2O中的一种,对应的e、f分别为Na2CO3、NaOH中的一种,d为Na2O2,元素W为H,X为C,Y为O,Z为Na。
A.同一周期的元素从左到右原子半径逐渐减小,同一主族自上而下原子半径增大,所有元素中氢原子半径最小,所以原子半径:W(氢)<Y(氧)<X(碳)<Z(Na),A错误;
B.元素的非金属性越强,其相应的阴离子的还原性就越弱。元素的非金属性O>H,所以阴离子的还原性:H->O2-,即阴离子的还原性:Y<W,B错误;
C.a燃烧生成CO2、H2O,属于氧化还原反应,而CO2、H2O与Na2O2的反应是也是氧化还原反应,C正确;
D.a燃烧生成CO2、H2O,则a可为烃,也可能是烃的含氧衍生物,D错误;
故合理选项是C。

 名校课堂系列答案
名校课堂系列答案【题目】相同温度下,容积相同的甲、乙、丙3个恒容密闭容器中发生可逆反应:2SO2(g)+O2(g)![]() 2SO3(g);
2SO3(g); ![]() 。实验测得起始、平衡时的有关数据如下表:
。实验测得起始、平衡时的有关数据如下表:
容器 | 起始各物质的物质的量/mol | 达到平衡时体系能量的变化 | |||
SO2 | O2 | SO3 | Ar | ||
甲 | 2 | 1 | 0 | 0 | 放出热量:Q1 |
乙 | 1.8 | 0.9 | 0.2 | 0 | 放出热量:Q2 |
丙 | 1.8 | 0.9 | 0.2 | 0.1 | 放出热量:Q3 |
下列叙述正确的是 ( )
A.Q1=Q2=Q3="197" kJ
B.若在上述条件下反应生成2molSO3(s)的反应热为△H1,则△H1<-197 kJ·mol-1
C.甲、乙、丙3个容器中反应的平衡常数不相等
D.达到平衡时,丙容器中SO2的体积分数最大