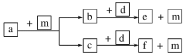
题目内容
【题目】将等物质的量的金属Na、Mg、Al分别与100 mL 2 mol·L1的盐酸反应,实验测得生成气体的体积V(已折合为标准状况)与时间t的关系如图所示,则下列说法不正确的是
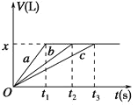
A. x=2.24
B. 三种金属的物质的量均为0.2 mol
C. 反应时,Na、Mg、Al均过量
D. 曲线b为Mg与盐酸反应的图象
【答案】C
【解析】
由于最后生成的气体量相同,所以这些金属置换出的氢气量相等,即等物质的量的三种金属失去了相同数量的电子,而若盐酸过量的话,这些金属失去的电子数应该是不一样的,比值应是1:2:3,所以推断出盐酸不可能过量,但可能刚好和Na反应完全,此时Na完全反应而Mg、Al还有剩余。
A.由于酸不足,所以生成氢气的量为:n(H2)= ![]() n(HCl)=0.1 mol,所以标况下的体积为2.24 L,A正确;
n(HCl)=0.1 mol,所以标况下的体积为2.24 L,A正确;
B.生成0.1 mol的氢气需0.2 mol的钠,因此三种金属的物质的量均为0.2 mol,B正确;
C.Na不可能过量,若Na过量会与溶剂水反应,C错误;
D.按照金属活动性顺序,Na>Mg>Al,则中间那条线是Mg与盐酸反应的图象,D正确;答案选C。

【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),
CO(g)+H2O(g),
其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K =__________________。
(2)该反应为__________反应(“吸热”或“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是_______________。
a.容器中压强不变 b.混合气体中 c(CO)不变
c.υ正(H2)=υ逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为________℃。
【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= ______
(2)该反应为 ______ 反应(选填“吸热”“放热”).
(3)能判断该反应是否达到化学平衡状态的依据是 ______ .
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合c(CO2)c(H2)=c(CO)c(H2O),试判断此时的温度为 ______ ℃.在此温度下2L密闭容器中进行反应CO2(g)+H2(g)CO(g)+H2O(g),CO2(g)和H2(g)的起始量均为2.0mol,达到平衡时CO2的转化率为 ______ .
(5)在密闭容器中进行反应①Fe(s)+CO2(g)FeO(s)+CO(g)△H1=akJmol-1
反应②2CO(g)+O2(g)2CO2(g)△H2=b kJmol-1
反应③2Fe(s)+O2(g)2FeO(s)△H3
则△H3= ______ (用含a、b的代数式表示).
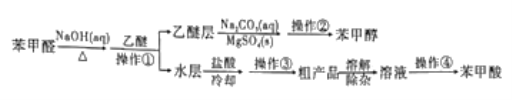
【题目】利用苯甲醛(C6H5CHO)在NaOH溶液中可以制苯甲醇(C6H5CH2OH)和苯甲酸(C6H5COOH)。实验流程如图:
相关物质的性质如下表所示。回答下列问题:
物质 | 对水的相对密度 | 沸点 | 溶解性 |
苯甲醇 | 1.04 | 205.7 | 微溶于水,易溶于乙醚 |
苯甲酸 | 1.27 | 249 | 微溶于冷水,可溶于热水,易溶于乙醚 |
乙醚 | 0.71 | 34.6 | 与水互不相溶 |
(1)操作①中,需要用到的玻璃仪器除烧杯外,还有____。操作①后,苯甲醇在容器中混合物的_____(填“上”或“下”)层。
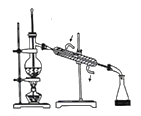
(2)乙醚层用10%Na2CO3溶液洗涤的目的是_____。操作②前常需要加入MgSO4,作用是______。操作②的装置如图,指出该装置图中两个错误:______。
(3)操作③是______,操作④是______。
(4)取106.00g苯甲醛反应,若苯甲醛的转化率为80%,乙醚的萃取率为100%,洗涤等过程损失率为10%,则最终可制得苯甲醇___g(结果保留小数点后两位)。
【题目】(1)某同学用托盘天平称量烧杯的质量,天平平衡后的状态如图。由图中可以看出,该同学在操作时的一个错误是__,烧杯的实际质量为__(最小砝码为5g)。

(2)已知某“84”消毒液瓶体部分标签如图所示,该“84”消毒液通常稀释100倍(体积之比)后使用。请回答下列问题:
有效成分 | NaClO |
规格 | 1000mL |
质量分数 | 25% |
密度 | 1.19g·cm-1 |
①该“84”消毒液物质的量浓度约____ mol·L-1(保留一位小数)。
②某同学取20mL该“84”消毒液,稀释后用于消毒,稀释后的溶液中c(Na+)=__mol·L-1。
③“84”消毒液与稀硫酸混合使用可增强消毒能力,某消毒小组人员用浓硫酸配制稀硫酸用于增强“84”消毒液的消毒能力,下列操作使所配制的硫酸溶液浓度偏低的是__。
a.量取浓硫酸时,俯视量筒刻度线 b.未经冷却就将溶液转移至容量瓶
c.溶液定容摇匀后,有少量流出 d.没有洗涤量取浓硫酸的量筒
e.定容时仰视容量瓶刻度线 f.容量瓶内残留一定量蒸馏水