题目内容
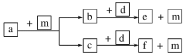
【题目】一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列叙述正确的是

A.反应的化学方程式为2X(g)+Y(g)![]() 2Z(g)
2Z(g)
B.10s后,该反应停止进行
C.反应开始到10s,用Z表示的反应速率为0.158mol·L-1·s-1
D.0~10 s的时间内的平均反应速率:v(X)=v(Y)=0.0395mol·L-1·s-1
【答案】D
【解析】
随着反应的进行,反应物会逐渐减少,生成物会逐渐增大,到10s时各种物质都存在,且不再发生变化,表明该反应为可逆反应,根据在相同时间内各种物质改变的物质的量的比等于方程式的化学计量数的比,确定方程式的系数,并根据反应速率的概念v=![]() 计算反应速率,根据同一反应用不同物质表示的反应速率比等于化学计量数的比,判断不同物质的速率间的关系。
计算反应速率,根据同一反应用不同物质表示的反应速率比等于化学计量数的比,判断不同物质的速率间的关系。
A.由图象可以看出,随反应进行X、Y的物质的量减小,Z的物质的量增大,所以X、Y是反应物,Z是生成物,l0s后X、Y、Z的物质的量为定值,不为0,反应是可逆反应,且△n(X):△n(Y):△n(Z)=(1.20-0.41)mol:(1.00-0.21)mol:1.58mol=1:1:2,参加反应的物质的物质的量之比等于化学计量数之比,故反应化学方程式为X(g)+Y(g)![]() 2Z(g),A错误;
2Z(g),A错误;
B.由图可知,l0s后,该反应到达平衡状态,化学平衡状态是动态平衡,v(正)=v(逆)≠0,B错误;
C.10s内,用Z表示的反应速率为v(Z)=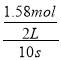 =0.079moL/(Ls),C错误;
=0.079moL/(Ls),C错误;
D.反应开始到10s,反应的X、Y的物质的量变化了0.79mol,则v(X)=v(Y)=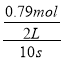 =0.0395mol·L-1·s-1,D正确;
=0.0395mol·L-1·s-1,D正确;
故合理选项是D。

【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= ______
(2)该反应为 ______ 反应(选填“吸热”“放热”).
(3)能判断该反应是否达到化学平衡状态的依据是 ______ .
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合c(CO2)c(H2)=c(CO)c(H2O),试判断此时的温度为 ______ ℃.在此温度下2L密闭容器中进行反应CO2(g)+H2(g)CO(g)+H2O(g),CO2(g)和H2(g)的起始量均为2.0mol,达到平衡时CO2的转化率为 ______ .
(5)在密闭容器中进行反应①Fe(s)+CO2(g)FeO(s)+CO(g)△H1=akJmol-1
反应②2CO(g)+O2(g)2CO2(g)△H2=b kJmol-1
反应③2Fe(s)+O2(g)2FeO(s)△H3
则△H3= ______ (用含a、b的代数式表示).
【题目】(1)某同学用托盘天平称量烧杯的质量,天平平衡后的状态如图。由图中可以看出,该同学在操作时的一个错误是__,烧杯的实际质量为__(最小砝码为5g)。

(2)已知某“84”消毒液瓶体部分标签如图所示,该“84”消毒液通常稀释100倍(体积之比)后使用。请回答下列问题:
有效成分 | NaClO |
规格 | 1000mL |
质量分数 | 25% |
密度 | 1.19g·cm-1 |
①该“84”消毒液物质的量浓度约____ mol·L-1(保留一位小数)。
②某同学取20mL该“84”消毒液,稀释后用于消毒,稀释后的溶液中c(Na+)=__mol·L-1。
③“84”消毒液与稀硫酸混合使用可增强消毒能力,某消毒小组人员用浓硫酸配制稀硫酸用于增强“84”消毒液的消毒能力,下列操作使所配制的硫酸溶液浓度偏低的是__。
a.量取浓硫酸时,俯视量筒刻度线 b.未经冷却就将溶液转移至容量瓶
c.溶液定容摇匀后,有少量流出 d.没有洗涤量取浓硫酸的量筒
e.定容时仰视容量瓶刻度线 f.容量瓶内残留一定量蒸馏水
【题目】二氧化锰是制造锌锰干电池的基本材料,工业上以软锰矿、菱锰矿为原料来制备。某软锰矿主要成分为 MnO2,还含有 Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和 Cu(0.86%)等元素的化合物,其处理流程图如下:
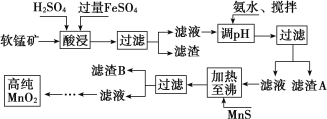
化合物 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
Ksp 近似值 | 10-34 | 10-16 | 10-38 |
(1)硫酸亚铁在酸性条件下将 MnO2 还原为 MnSO4,酸浸时发生的主要离子反应方程式为:_____________ ;
(2)“氨水、搅拌”,其中“搅拌”不仅能加快反应速率,还能______________, 滤渣 A 的成分是 Fe(OH)3、Al(OH)3,加入氨水需调节 pH 至少达到_________________,恰好能使 Fe3+、Al3+沉淀完全(当 c≤10-5 mol·L-1 时,认为该离子沉淀完全);
(3)滤渣 B 的成分是 ________________
(4)MnO2 也可在 MnSO4-H2SO4-H2O 为体系的电解液中电解获得,其阳极反应式为:______________ 工业上采用间接氧化还原滴定法测定 MnO2 纯度,其操作过程如下:准确称量 0.920 0 g 该样品,与足量酸性 KI 溶液充分反应后,配制成 100 mL 溶液。取其中 10.00 mL,恰好与 25.00 mL 0.080 0 mol·L-1Na2S2O3溶液反应(I2 +2S 2O32-===2I-+S 4O62-)。计算可得该样品纯度为_____%(保留三位有效数字)。