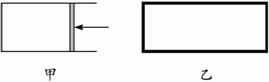题目内容
一定温度下,分别往容积均为5L的甲(恒压容器)、乙(恒容容器)中加入0.5mol无色的N2O4气体,立即出现红棕色。当反应进行到2s时,测得乙容器中N2O4的浓度为0.09mol?L-1。经过60s,乙容器中的反应达到平衡。(反应过程中两个容器的温度均保持恒定)
(1)容器中气体出现红棕色的原因是__________(用化学方程式表示)。
(2)前2s内乙容器中以N2O4的浓度变化表示的反应速率为_____________。
(3)达到平衡时,甲容器中反应所需的时间______60s(填“大于”、“小于”或“等于”,下同);容器内N2O4的浓度甲______乙。
(4)若要使甲、乙容器中N2O4浓度相等,不能采取的措施是__________。
A.保持温度不变,适当压缩甲容器的体积
B.保持容器体积不变,使甲容器升温
C.保持容器体积和温度不变,向甲容器中加入适量N2O4
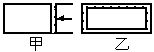
(1)N2O4(g)
 2NO2(g)
2NO2(g)(2)0.005mol?L-1?s-1
(3)大于;小于
(4)B
【试题分析】

练习册系列答案
相关题目
 如图,一定温度下,分别往容积均为 5L 的甲(恒压容器)、乙(恒容容器)中加入 0.5mol无色的N2O4气体,立即出现红棕色.当反应进行到 2s时,测得乙容器中N2O4的浓度为 0.09mol?L-1.经过 60s,乙容器中的反应达到平衡.(反应过程中两个容器的温度均保持恒定)
如图,一定温度下,分别往容积均为 5L 的甲(恒压容器)、乙(恒容容器)中加入 0.5mol无色的N2O4气体,立即出现红棕色.当反应进行到 2s时,测得乙容器中N2O4的浓度为 0.09mol?L-1.经过 60s,乙容器中的反应达到平衡.(反应过程中两个容器的温度均保持恒定)