题目内容
如右图,一定温度下,分别往容积均为 5L 的甲(恒压容器)、乙(恒容容器)中加入 0.5mol无色的N2O4气体,立即出现红棕色。当反应进行到 2s时,测得乙容器中N2O4的浓度为 0.09mol·L-1。经过 60s,乙容器中的反应达到平衡。(反应过程中两个容器的温度均保持恒定)
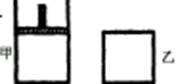
(1)容器中气体出现红棕色的原因(用化学方程式表示)是: 。(2)前 2s内乙容器中以N2O4的浓度变化表示的反应速率为 。
(3)达到平衡时,甲容器中反应所需的时间 60s(填“大于”、“小于”或“等于”,以下同);容器内N2O4的浓度甲 乙;反应过程中吸收的能量甲 乙。
(1)N2O4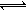 2NO2(2)0.005mol·L-1·s-1(3)大于;小于;大于
2NO2(2)0.005mol·L-1·s-1(3)大于;小于;大于
【解析】试题分析:(1)加入N2O4以后会出现一个平衡移动N2O4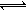 2NO2,N2O4是无色的,但是NO2是红棕色的,所以会出现红棕色。(2)已知乙容器中2s后N2O4的浓度为 0.09mol·L-1,根据
2NO2,N2O4是无色的,但是NO2是红棕色的,所以会出现红棕色。(2)已知乙容器中2s后N2O4的浓度为 0.09mol·L-1,根据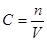 可计算出2s后剩余N2O4的物质的量为
0.45mol,反应开始时N2O4的物质的量为
0.5mol,则物质的量变化了0.05mol,根据
可计算出2s后剩余N2O4的物质的量为
0.45mol,反应开始时N2O4的物质的量为
0.5mol,则物质的量变化了0.05mol,根据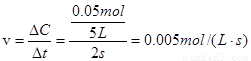 。(3)甲所需要的时间大于乙,因为甲是压强不变,N2O4
。(3)甲所需要的时间大于乙,因为甲是压强不变,N2O4 2NO2,甲的压强不变,所以体积变大,所以甲中N2O4的浓度是变小的,反应速率变小,所以大于60s。但是乙中N2O4只是消耗,所以变化幅度小。单位体积内的N2O4的浓度会变小,N2O4浓度甲小。因为浓度变小了,所以反应程度小了,所以甲吸收的能量也小。
2NO2,甲的压强不变,所以体积变大,所以甲中N2O4的浓度是变小的,反应速率变小,所以大于60s。但是乙中N2O4只是消耗,所以变化幅度小。单位体积内的N2O4的浓度会变小,N2O4浓度甲小。因为浓度变小了,所以反应程度小了,所以甲吸收的能量也小。
考点:影响化学反应速率的因素
点评:影响化学反应速率的因素包括了浓度、体积和其他的因素,本题主要从浓度和体积上来研究对化学反应速率的影响,所以一定要注意外界条件是在改变什么,什么因素影响为主要因素,才能更好解决本道题。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案(1)土壤的pH一般在4~9之间。土壤中Na2CO3含量较高时,pH可以高达10.5,试用离子方程式解释土壤呈碱性的原因 ;加入石膏(CaSO4 2H2O)可以使土壤碱性降低,有关反应的化学方程式为 。
2H2O)可以使土壤碱性降低,有关反应的化学方程式为 。
(2)在一定条件下进行如下反应:aX(g)+bY(g) cZ(g)
cZ(g)
右图是不同温度下反应达到平衡时,反应混合物中Z的体积分数 和压强关系示意图。
① 写出该反应的化学平衡常数表达式:K= 。随着温 度的升高,K值 (填“增大”、“减小”或“不变”)。当反应物起始浓度相同时,平衡常数K值越大,表明 (字母填序号)。
| A.X的转化率越高 | B.反应进行得越完全 |
| C.达到平衡时X的浓度越大 | D.化学反应速率越快 |

 2H2O)可以使土壤碱性降低,有关反应的化学方程式为 。
2H2O)可以使土壤碱性降低,有关反应的化学方程式为 。 cZ(g)
cZ(g) 
 2NH3(g)的△H= ▲ 。
2NH3(g)的△H= ▲ 。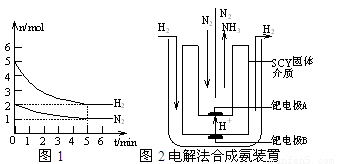
 CO(g)+3H2(g) ΔH1
CO(g)+3H2(g) ΔH1